七、此测定是基于下列反应:
还 原 :PbO + 4H+ + C O2− === Pb2+ + 2H O + 2CO
2 2 4 2 2
滴定:2MnO− + 5C O2− + 16H+
=== 2Mn2+ + 10CO + 8H O
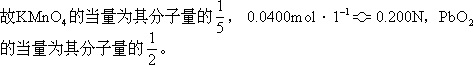
①滤液酸化后,KMnO4 滴定的毫克当量是多余的 H2C2O4 的毫克当量数:0.200×10.20=2.04(毫克当量)
②PbC2O4 沉淀消耗的 KMnO4 是全部 Pb2+的毫克当量数:0.200× 30.25=6.05(毫克当量)
③还原 PbO2 和生成的 PbC2O4 沉淀共消耗草酸为:2×0.2500×
20.00−2.04=7.96(毫克当量)。其中用于 PbO2 的还原的毫克当量数是:
7.96−6.05=1.91(毫克当量);用于 PbO 的沉淀的毫克当量数是:
6.05−1.91=4.14(毫克当量)所以样品分析结果为:
1.91 × 239.2
PbO2
%= 2 ×100% = 31.12% 0.7340 × 1000
223.2
4.14 × 2
PbO% = 0.7340 × 1000 ×100%=62.95%
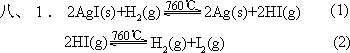
 HI+NaOH
NaI+H2O (3)
HI+NaOH
NaI+H2O (3)
 3I2+6NaOH
5NaI+NaIO3+3H2O (4)
3I2+6NaOH
5NaI+NaIO3+3H2O (4)
 NaOH+NCl
NaCl+H2O (5)
NaOH+NCl
NaCl+H2O (5)
2.(1)由上述方程式可知,干燥尾气中仅有稀有气体和氢气,所以n(稀)+n(H2)=PV/RT=101.3×0.2549/(8.314×290.0)=1.071×
10−2(mol)(2)由原始气体的体积比,可知稀有气体和氢气的物质的量相等;又由反应(1),(2)可知,通过舟皿后体系中 HI 的物质的量,是被消耗的 H2 的物质的量的 2 倍,故有:
 n(稀)+n(H2)
[n(H2)+n(HI)/2)]+n(H2) 1.071×10−2=2n(H2)+n(HI)/2
n(HI)=2.142×10−2−4n(H2) (1)
n(稀)+n(H2)
[n(H2)+n(HI)/2)]+n(H2) 1.071×10−2=2n(H2)+n(HI)/2
n(HI)=2.142×10−2−4n(H2) (1)
-
由反应(3)、(4)可知n(HI)+2n(I2)=(20.00−4.50)×10−3×0.1000 n(HI)+2n(I2)=1.550×10−3(mol) n(I2)=0.775×10−3−1.071×10−2+2n(H2) n(I2)=2n(H2)−0.9935×10−2 (2)
-
根据 760℃纯 HI 的分解百分率可求得 760℃时的 Kc:
 2HI
H2 + I2
2HI
H2 + I2
开始时 ni/mol:x 0 0
平衡时n / mol:x(1 - 0.30) 1 ×0.30x 1 ×0.30x
i 2 2
1 1
Kc =
[ 2 × 0.30x / V][ 2 × 0.30x / V] [x(1 − 0.30) / V]2
= 0.04592
即 Kc
= [ n(H 2 ) / V][n(I 2 ) / V] [ n(HI) / V]2
0.04592=n(H2)·n(I2)/[n(HI)]2⋯⋯(3)
解(1)、(2)、(3)联立方程组,可求得 n(H2)=0.4973×10−2mol 3.反应(1)产生的 HI,在反应(2)中部分分解,由反应(1),(2)的化
学计量数可知,反应(1)产生的 HI 的总物质的量为:n(HI)+2n(I2),此
也是反应(1)生成的 Ag 的物质的量。由前述方程式(2)可知: n(HI)+2n(I2)=1.550×10−3mol,n(Ag)=1.550×10−3mol
4.舟皿中的混合物冷却后,可用 NaCN 溶液处理,AgI 溶解:AgI+2CN−
→[Ag(CN)2]−+I−过滤分离出不溶物即为银。1988 年复赛试题
|
一、选择题 |
|||
|---|---|---|---|
|
1.(B) |
2.(C) |
3.(E) |
4.(C,D) |
|
5.(D) |
6.(C) |
7.(D) |
8.(D, E) |
|
9.(D) |
10.(D) |
11.(B) |
12.(E) |
|
13.(C) |
14.(D) |
15.(C) |
16.(D) |
|
17.(C) |
18.(D) |
19.(C) |
20.(D) |
|
21.(A) |
22.(C) |
23.(A) |
24.(D) |
