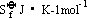1987 年复赛试题
一、指出下列化合物活性由强到弱的顺序(10 分)
- 环的稳定性 。
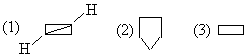
- 碱性强弱 。
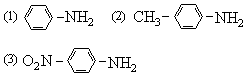
- 酸性强弱 。
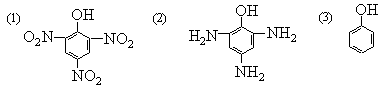
- 水中溶解度 。
(1)甘油 (2)1—丁醇 (3)桐油5.水解速度 。
- CH3COOC2H5 (2)CH3CONH2 (3)CH2COCl
二、根据下列实验事实,鉴别注字母的各物质,将化学式填入相应的空格内(10 分)。
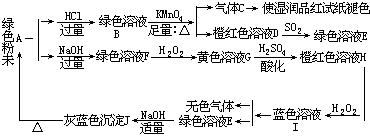
A ,B ,C ,D ,E ,F , G , H , I , J 。
三、(本题 8 分)
在室温下,铜线暴露在空气中时,其表面逐渐覆盖一层黑色氧化物CuO。当此铜线被加热超过一定温度后,黑色 CuO 就转变为红色氧化物
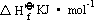 Cu2O。试通过计算解释上述两种现象,并估计后一种现象发生时的温度。已知有关物质在
298K 时的热力学数据如下:
Cu2O。试通过计算解释上述两种现象,并估计后一种现象发生时的温度。已知有关物质在
298K 时的热力学数据如下:
|
Cuo(s) |
Cu O(s) 2 |
Cu(s) |
O (g) 2 |
|
|---|---|---|---|---|
| -1 |
-155 |
-167 |
||
|
|
43.5 |
101 |
33.3 |
205 |
四、(本题共 20 分)
试解释以下现象,并写出有关化学方程式: 1.金属锌溶于氨基钠(NaNH2)的液氨溶液中,并释放出氢气;小心
加入碘化铵产生白色的沉淀,若继续加入碘化铵,沉淀溶解。
但是,在水溶液中,Cu2+离于可以从碘化钾中释放出 I2。3.在工矿企业工作长期接触重金属的人,如果防护不严,吸入重金
 属积聚体内可引起中毒,其原因是重金属离子如
Hg2+等,能使含有巯基的蛋白酶
属积聚体内可引起中毒,其原因是重金属离子如
Hg2+等,能使含有巯基的蛋白酶
-
人体血浆中正常的 pH 值为 7.35~7.42,如果 pH 值高于 7.50 或低于 7.20 分别表现为代谢性碱中毒或酸中毒,为纠正酸碱失调,临床上一般给患者补给化学药物(既可口服又可静脉注射)来纠正。试分别指出补给的药物名称及纠正的过程。
-
解释下列分子的空间构型:BF3(平面三角形),NF3(三角锥形), ClF3(T 形)
-
解释三卤化硼接受电子对的能力是 BF3<<BCl3<BBr3 五、(本题 10
分)
在叔丁醇中加入金属钠,当钠被消耗后,在反应混合物中加入溴乙
烷,这时可以得到 C6H14O;若在乙醇和金属钠反应的混合物中加入 2−甲基−2−溴丙烷,则有气体产生,在留下的混合物中仅有一种有机物—乙醇,写出上述反应方程式。
六、(本题共 10 分)
等电点是氨基酸和蛋白质的一个重要物理化学特征。当溶液的 pH 值与等电点(等电 pH)一致时,化合物的总电荷为零,下表中列出某些氨基酸的等电点,指出在标明的 pH 值下,各氨基酸在电场中的移动方向(向正极或负极),并说明原因。
| 氨基酸 |
等电点(pH) |
指明的pH |
氨基酸在电场中移动方向 |
|---|---|---|---|
| 缬氨酸 |
5.96 |
8 |
|
| 丝氨酸 |
5.68 |
1 |
|
| 赖氨酸 |
9.74 |
12 |
|
| 谷氨酸 |
3.22 |
7 |
七、(本题 12 分)
有一 PbO 和 PbO2 的混合物,用高锰酸钾法测定其含量。称取该样品0.7340 克,加入 20.00 毫升 0.2500mol·L−1 草酸溶液,将 PbO2 还原为Pb2+,然后用氨水中和溶液使全部 Pb2+形成 PbC2O4 沉淀。过滤后将滤液酸化,用标准 KMnO4 溶液滴定,计用去 0.0400mol·L−1KMnO4 溶液 10.20 毫升,沉淀溶解于酸中再用同一 KMnO4 标准溶液滴定,用去 30.25 毫升, 计算试样中 PbO 和 PbO2 的百分含量(铅的原子量:207.2)。
八、(本题共 20 分)
760℃和 1013.3kPa 下,令氢气和某稀有气体(体积比为 1∶1)慢慢通过盛有熔融 AgI 的舟皿,而使部分 AgI 还原为 Ag。然后让反应后的气体通过盛有 20.00cm30.1000mol·dm−3NaOH 的洗气瓶,并收集干燥后的尾气。某次实验后,洗气瓶内的溶液可以被 4.500dm30.1000mol·dm−3 的 HCl溶液中和,并在 17.0℃101.3kPa 下收集得干燥尾气 254.9cm3(已知 760
℃时纯 HI 气体有 30.00%分解为单质)。1.写出该实验过程中所发生的全部反应的方程式,并配平。
-
计算尾气中氢气的物质的量。
-
计算舟皿中银的物质的量。
-
如何将银从 AgI 中分离出来。