1990 年竞赛试题
(时限:150 分;满分 120 分)
原子量:H(1.0),C(12.01),N(14.0),O(16.0),F(19.0),Al(27.0),
S(32.1),Cl(35.5),K(40),Ba(137),Fe(56),Cu(63.5),Ag(108), I(127), Na(23.0),Mg(24.3)
注意:(1)答题一律不准使用计算器;
(2)第一二大题都是选择题,各有 1~2 个正确答案,全对者才给分。一、选择题(共 10 分)
-
下列说法错误的是 [ ]
-
氢原子只有一个 1s 轨道
-
氢 原 子 的 1s 轨 道 呈 球
形C.氢原子的电子在核附近出现的机会最多 D.氢原子的电子在核附近单位体积内出现的机会最多
-
-
在铜跟稀硝酸的反应中,如果有一摩的硝酸被还原,则被氧化的铜的物质的量为
[ ]
3
- 8 摩
8
. 3 摩
- 3摩
3
. 2 摩
|
3.下列物质中熔点最高的是 |
[ |
] |
|
|---|---|---|---|
|
A.水晶 B.干冰 |
C.冰 |
D.冰晶石 |
- 下列各组离子中,能大量共存于同一溶液的是 [ ] A.Fe3+ Fe2+ Cu2+ Cl−
B.F− SO2−
I− H+
C.H2PO4− PO3− Na+ Cl− D.I− Fe3+ K+ H+
- pH=2.7 的一元弱酸,加水稀释,若溶液体积扩大 10 倍,则[H+]
或[OH−]的变化是 [ ]
A.[H+]增大 B.[H+]、[OH−]都减小
C.[OH−]增大 D.[OH−]减小
- 在 NaCl 晶体中,每个 Cl−周围的 Na+个数是 [ ]
A.8 B.4 C.6 D.以上都不对
- 元素 X 的气态氢化物的分子式为
H2X,这种元素的最高价氧化物的水化物的分子式可能是 [ ]
A.H2XO3 B.X(OH)2
C.H2XO4 D.H6XO6
- 将 H2,Cl2 等体积混合于密封容器中,用强紫外线照射时,则容
|
器内的压力 |
[ | ] | ||
|---|---|---|---|---|
|
A.增大 |
B.减小 |
C.不变 |
D.难以确定 | |
|
9.下列化合物不具两性的是 |
[ | ] |
A.NaHCO3 B.NaHSO4 C.H2N—CH2COOH

- 单糖类是 [ ]
A.多羟基化合物 B.醛类或酮类C.多羟基醛或多羟基酮 D.多羟基醛
二 、 选 择 题 ( 共 40 分 ) 1.在下列操作中,原溶液不能保持澄清的是 [ ]
A.往饱和的 CaCl2 溶液中通入 CO2 B.往硫酸铜溶液中加入少量氨水 C.往硅酸钠溶液中加入氯化铵溶液 D.往氢氧化钠溶液中滴入少量硫酸锌溶液
 对于可逆反应:C(固)+H2O(气)
CO(气)+H2(气)−Q 下列说法正
对于可逆反应:C(固)+H2O(气)
CO(气)+H2(气)−Q 下列说法正
确的有 [ ]
A.达到平衡时各产物浓度相等 B.恒容充入水蒸气,使体系压强增大,平衡向右移动C.加入正催化剂,正反应速率增大,平衡向右移动
- 升高温度,正反应速率增大,逆反应速率减小,平衡向右移动
3 .将 0.2 摩某固体硝酸盐 M(NO3)2 加热分解,反应式为
 2M(NO3)2
2MO+4NO2+O2,将产生的气体用排水法收集,在标况下,收
2M(NO3)2
2MO+4NO2+O2,将产生的气体用排水法收集,在标况下,收
|
集到的气体体积接近 |
[ |
] | ||
|---|---|---|---|---|
|
A.11.2 升 |
B.5.23 升 |
C.1.74 升 |
D.0 升 |
 下列反应方程式中,书写不正确的是
[ ] A.NH4NO3 N2O+2H2O
下列反应方程式中,书写不正确的是
[ ] A.NH4NO3 N2O+2H2O
 B.HCO−
+H O OH−+H CO
B.HCO−
+H O OH−+H CO
C.Fe3++Cu=Cu2++Fe2+ D.Mg(HCO3)2+Ca(OH)2=MgCO3↓+CaCO3↓+2H2O
- 下列说法正确的有: [ ]
A.离子晶体一定含有金属离子
- 2O 分子中氢与氧化合价已饱和,不能再与原子或离子形成化学键C.PH3 的分子量比 NH3 大,因此 PH3 的熔沸点比 NH3 高D.金刚石中的共价键比石墨中的共价键弱
- 用 Zn 与稀 H2SO4 反应制取 H2 气时,观察到反应速率变化是
[ ]
A.由快→慢 B.由慢→快
C.由慢→快→慢 D.由快→慢→快
7 .已知 2BrO− +Cl =Br +2ClO−
5Cl +I +6H O=2HIO +10HCl
3 2 2 3 2 2 2 3
ClO− +5Cl−+6H+=3Cl +3H O 判断下列物质的氧化能力的顺序是 [ ]
-
ClO− >BrO− >IO − >Cl
-
BrO − >Cl >ClO − >IO −
3 2 3 3
- BrO − >ClO− >Cl >IO −
3 3 2 3
- Cl >BrO − >ClO − >IO −
- 粘土胶体溶液中,粘土粒子带负电,为了使粘土粒子凝聚,下列物质中用量最少最有效的电解质是 [ ]
A.磷酸钠 B.硫酸铝 C.氯化钡 D.硫酸钾9.以已知浓度的 NaOH 溶液滴定未知浓度的醋酸溶液,下列操作中
会使测定结果偏低的有 [ ]
- 以甲基橙作指示剂 B.锥形瓶沾有少量的蒸馏水 C.滴定前,滴定管尖端有气泡未排出D.滴定后,滴定管尖端有气泡未排出E.滴定到达终点,即刻读数
- 将 12C 的 1 摩原子的质量作为 12.00 克时,13C 的 1 摩原子的质量是 13.00 克,天然存在的碳的同位素原子含量比 12C/13C 接近为
[ ]
A.100 B.90 C.80 D.70
- 化学反应 aA+bB=dD+eE,已知40 克 A 和 21 克 B 恰好完全反应生成 28 克 D,则 B、E 两种物质的摩尔质量之比是 [ ]
A 7 10 10 7 11 7 7 11
. d ∶ a
-
d ∶ a
-
e ∶ b
-
b ∶ e
 已知
1123K 时,反应:CaCO3(固) CaO(固)+CO2(气)的平衡常数 Kp=0.5
大气压,在 1123K 时,下列各种情况能建立化学平衡的是
已知
1123K 时,反应:CaCO3(固) CaO(固)+CO2(气)的平衡常数 Kp=0.5
大气压,在 1123K 时,下列各种情况能建立化学平衡的是
[ ]
-
密闭容器中有 CaO、CO2(1 大气压)
-
密闭容器中有 CaCO3、CO2(1 大气压)
-
密闭容器中有 CaO、CO2(0.1 大气压)
-
密闭容器中有 CaCO3、CaO、CO2(0.1 大气压)
- 取 2.5cm3 0.1mol·dm−3Na2S,1cm3 0.1mol·dm−3Na2SO3 和 7cm3 0.1mol·dm−3HCl 三种溶液混合后,体系中硫以各种形式存在的相对含量是 [ ]
A.H2S>SO2>S2−>S B.H2S>S2−>S>SO2
C.S>H2S>S2−>SO2 D.H2S>S>S2−>SO2
- 将装有 15 毫升 NO2 和 O2 的试管,倒立在盛水的水槽中,最后试管内剩余 3 毫升气体,则试管中原气体的组成可能是 [ ]
A.NO2:9.6 毫升,O2:5.4 毫升
B.NO2:13.8 毫升,O2:1.2 毫升C.NO2:6 毫升,O2:9 毫升D.NO2:11.25 毫升,O2:3.75 毫升
- 下列每组有机化合物,一定属于同系物的有 [ ] A.C2H6 和 C4H10
B.C2H2 和 C4H6
 C.C2H4
和 C4H8
C.C2H4
和 C4H8
- 某化合物不溶于水,不溶于稀盐酸,不溶于稀 NaOH,不溶于稀NaHCO3 溶液,该物质可能是 [ ]
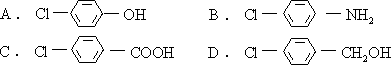
- 化合物 CH2=CH—CH=CH—CH=CH2 与一分子溴反应时,可能得到异
|
构体的种类数是 |
[ |
] |
||
|---|---|---|---|---|
|
A.一种 |
B.二种 |
C.三种 |
D.四种 |
-
下列物质中自身既不能发生加成聚合反应也不能发生缩合聚合反应的是 [ ]
- 氨基乙酸 B.苯酚 C.甲醛 D.苯乙烯
-
有 CH4、C2H2、C6H6、CH3COCH3、油脂五类有机化合物,它们的共性是 [ ]
- 难溶于水 B.燃烧时产生浓烟
C.发生取代反应 D.完全燃烧时只生成 CO2 和 H2O 20.在下列物质的水溶液中加入几滴稀硫酸,加热后再用碱中和,
与新制氢氧化铜悬浊液共热,有红色沉淀产生的是 [ ]
A.乙酸 B.淀粉 C.福尔马林 D.乙醇
三、填空题(共 15 分)
1.A、B 两元素,A 原子的 M 层和 N 层电子数分别比 B 原子的 M 层和 N 层的电子数少 5 个和 4 个,则 A 原子可能是 ,B 原子可能是 。
2 . H2O 的沸点 (100 ℃ ) 比 HF 的沸点(20 ℃ ) 高,这是由于
。
- IO−
与 I−在中性或碱性溶液中不起反应,在酸性溶液中能起反应
析出 I2。取 KIO3、KI、KHSO4 溶液各 10cm3,混合后恰好反应,反应后的溶液用 0.10mol·dm−3Na2S2O3 滴定,耗 Na2S2O320cm3。KHSO4 原来溶液的浓度是 。
- 虽然氟元素早在 1810 年就被发现,但 170 多年来化学家试图用
化学方法制取单质氟的尝试一直未获成功。直到 1986 年 Karl christe 终于由 HF 制得 F2。他提出的三步反应如下,试将它们完成并配平:
-
KMnO4+KF+H2O2—→K2MnF6+⋯⋯
-
SbCl5+HF—→SbF5+⋯⋯ (3)K2MnF6+SbF5—→KSbF6+MnF3+F2
-
在合成氨反应中,入口气体体积比为 N2∶H2∶NH3=6∶18∶1,出口气体体积比为
N2∶H2∶NH3=9∶27∶8。则氢的转化率为 。
-
于 100 毫升 0.1 摩/升的稀 H2SO4 中加入 1 摩/升的氨水 20 毫升,
溶液变成 性。在上述溶液中加入 0.1 摩/升 BaCl2 溶液,使溶液中的硫酸根离子和氯离子的摩尔浓度相等,加入氯化钡溶液的量是 毫升。
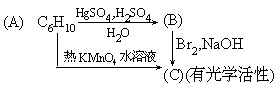 四、填空题(共
19 分) 1.写出化合物 A、B、C 的结构式:
四、填空题(共
19 分) 1.写出化合物 A、B、C 的结构式:
- >
- >
2.将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相接,铂片与电源负极相接,以电流强度 A 通电 10 分钟,然后将电源反接, 以电流强度 2A 继续通电 10 分钟,试回答:
-
以电极质量为纵坐标,时间为横坐标,分别作出铜电极、铂电极质量和两电极总质量与时间的关系图。
-
上述过程中两电极发生的现象是: 铜电极 ,
铂电极 。
- 最后时刻两电极的电极反应是: 铜电极 ,
铂电极 。 3.为了治理三废,对一废渣进行如下实验
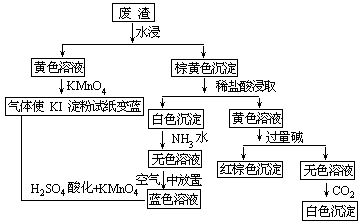
试推断废渣中可能存在的物质是 。五、实验题(共 16 分)
- 有八瓶 0.5mol·L−1 的无色溶液,它们可能是 NaHCO3、Na2CO3、Na2SiO3、NaNO3、Na3PO4、Na2SO3、Na2SO4 和 Na2S2O3。请设计一实验方案, 用最少试剂将它们一一鉴别出来。
要求:(1)用化学方法鉴别;(2)所用试剂尽可能少。本题按所用试剂多少记分:用最少试剂记满分;否则相应扣分;所用试剂超过四种或不能全部鉴别者,一律记 0 分。
- 有一混合溶液含苯甲醇、对甲苯酚、环己胺和苯。请设计一实验方案,将它们分离提纯。要求用框图简明表达,注明所用试剂及物质的存在形式。
六、计算题(共 20 分)
- 某白色粉末 A 为含一份金属的盐,难溶于水。灼烧 6.90 克 A 到
300℃,生成金属 B5.40 克和两种气体 C、D 组成的混合物 0.84dm3。将此混合气体通过灼热铜粉,充分反应,铜粉变黑,气体体积减少到 0.56dm3。所有气体体积都已换算为标准状况下的值。试通过计算确定上述注字母的物质。并写出所发生的热分解方程式。
- 有一密闭抽成真空的容器内,放有无水 FeSO4 与 0.095mol 硫磺,
通入纯氧,把体系加热,使它们发生化学反应。在恒定一大气压及 927K 下长时间保持平衡。经分析该条件下平衡气相含氧 0.005mol,残渣中并未发现残存的硫。试通过计算说明在该条件下残渣是什么?已知此条件下:
 2FeSO4(s)
Fe2O3(s)+SO2(g)+SO3(g)
2FeSO4(s)
Fe2O3(s)+SO2(g)+SO3(g)
 Kp=0.159(大气压)2
2SO3(g) 2SO2(g)+O2(g) Kp=0.050 大 气 压
Kp=0.159(大气压)2
2SO3(g) 2SO2(g)+O2(g) Kp=0.050 大 气 压
