和结构、组成有关的几个实验
此前讨论的实验主要是从化学平衡角度出发的,即使提到了结构,也是顺便捎带的。本节将专门讨论几个和结构、组成有关的实验(当然也离不开化学平衡)。
- 关于氢键
实验 1 分别量取 0.5molCHCl3、(CH3)2CO、C2H5OH 及 H2O,并测量其温度。然后分别混合 CHCl3 和(CH3)2CO,C2H5OH 和 H2O,搅拌并测量溶液温度所能达到的最高值。其实验结果是:前者升温 9—11℃,后者升温 4—5℃。
常温下这几种溶剂的热容差值不大,且两种混合液又都是(共)1mol,而今在两种情况下升温幅度明显不同,这是混合释热不同所引起的,显然 CHCl3 和(CH3)2CO 混合时释热更多。
已知 C2H5OH 和 H2O 能以任何比例互相混合的现象是和它们相互间形成氢键有关,而今形成氢键的释热量不如 CHCl3 和(CH3)2CO 混合时释热多。为了说明后两者互相溶解时释热量大,当然不能用比氢键弱的分子间作用力来解释,而只能用氢键来讨论。一般教科书上介绍氢键时强调了“和氟、氧、氮结合的氢,可能形成氢键”。而在 CHCl3、(CH3)2CO 中的氢原子都是和碳原子相结合,氧原子、氯原子也都是和碳原子相结合的,似乎没有生成氢键的前提,但不用氢键又不能解释上述实验事实。就是说还得从氢键上来考虑问题。
在 CHCl3 分子中,3 个 Cl 原子和 C 原子相连,Cl 原子是拉电子体,使和
- 个 Cl 相连的 C 原子(相对而言)正性增强了(和 CH4 中 C 原子相比);在(CH3)2CO 分子中,CH3 是推电子基团,因此和 2 个 CH3 相连的 C 原子的负性增强了,从而使与之相连的 O 原子变得更负,这样就有可能发生下列氢键的结合 Cl3CH⋯⋯OC(CH3)2。
这个实验的启示是,只要实验现象(在此处是释热量多少)能够重复(偶然性被排除),就必然有相应的原因,即使是不能运用已经学过的理论、观点顺利地解释,也应相信实验是事实。大量历史事实表明:恰好在实验结果和现有的理论、观点有矛盾时,促使人们去修改、完善或摈弃原先的理论、观点。在学习期间,遇到这种情况可使我们更深入理解某些问题,上述 CHCl3 和(CH3)2CO 间形成氢键就是一例。查参考资料得知:CHCl3 和(CH3)2CO 形成 1∶ 1 化合物时释热 10kJ/mol。
最后,尚需说明一个问题,在以上 2 个反应中都有氢键形成,为什么 CHCl3 和(CH3)2CO 间形成氢键释热量更大呢?从它们的结构上看,C2H5OH 和 H2O 之间形成的氢键肯定强于 CHCl3 和(CH3)2CO 之间形成的氢键,但其前者之所以释热量少是因为 C2H5OH 和 H2O 混合释热量是:“C2H5OH 和 H2O 间形成氢键释热量和折散 H2O 分子间、C2H5OH 分子间的氢键吸热量的代数和”;而 CHCl3 和(CH3)2CO 间形成氢键释热是它和折散 CHCl3 分子间、(CH3)2CO 分子间作用力的代数和(一般分子间作用力小于氢键间力)。
- 关于碱式盐的组成
许多教科书上记载着;CuSO4 液和 NaOH 液混合生成 Cu(OH)2 沉淀,然而
实际上是生成碱式硫酸铜,其组成随所用试剂溶液的浓度、相对用量、加试剂的顺序及温度等因素有关。现就其中的一个实验进行讨论。
实验 2 把一定量 NaOH 液加到等浓度(mol/l)CuSO4 溶液中,待生成沉淀后,测定残留在溶液中 Cu2+和 OH-的浓度,据此可推知沉淀的组成。实验发现,当所用 NaOH 液的体积是 CuSO4 液体积的 1.5 倍时,生成沉淀后残留在溶液中的 Cu2+、OH-小到可以忽略不计。即在此条件下,所加的 Cu2+、OH-均作为沉淀的组成析出。
因所用 NaOH 液和 CuSO4 液的浓度相同,所以其体积比即两反应物的摩尔
比,即沉淀中 Cu2+和 OH-的摩尔比为 1∶1.5。两者电荷不平衡,沉淀中必含有其他阴离子(此实验中只能是 SO2- ),其组成必是 Cu(OH) (SO ) 。由电中性规律可知 x=0.25,所以沉淀的组成是 Cu(OH)1.5(SO4)0.25 或 Cu4(OH)6SO4。
或 CuSO4·3Cu(OH)2(再次强调,此种碱式盐只是按这种方法制得的一种组成)。
文献报道用 0.1mol/lNaOH 和 CuSO4 应,则得 CuSO4·4Cu(OH)·2H2O;
Cu(OH)2 和 CuSO4 液共热,得 2CuSO4·5Cu(OH)2·2H2O⋯⋯
严格说来,初步确定组成时,必须同时测定残留在溶液中的 Cu2+、OH-、Na+及 SO2- 浓度,同时要注意生成的沉淀是一种或几种化合物(可根据 X 射线
衍射图判定,此处不讨论)。以上未提到这些是把问题(在已经知道结果的基础上)合理地简化了。
顺便提及:把 NaOH 液加到某些盐的溶液(如 Zn2+、Cd2+⋯盐)中时均有生成碱式盐沉淀的可能性。教科书上记载的:混合盐溶液和 NaOH 溶液生成氢氧化物,只是在一定条件下才能实现的反应。
- 测定氰络银(I)离子中配位数
实验 3 配制 0.010mol/lKCN 液和 0.010mol/lAgNO3 液,量取 10 份5mlAgNO3 溶液分盛于 1—10 号试管中,然后往 1 号试管中加 1mlKCN,2 号试管中加 2mlKCN,3 号试管加 3mlKCN,4⋯⋯把观察到的现象(出现浑浊)示于图 1-3 中。以相同体积混合时,溶液混浊度最甚(白色沉淀物是 AgCN)。加入不多于 5mlKCN 时溶液混浊度较轻和 AgCN 沉淀不完全有关;当加入多于5mlKCN 液时,混浊度减轻是 AgCN 溶于 CN-之故。当加入 10ml
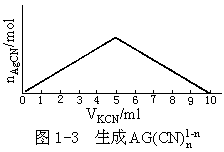
KCN 时恰好溶液变得澄清,表明 n=2,即 Ag(CN)-2。
需要强调,所以能用以上方法测定 AgCN、Ag(CN)-2 组成,是由于
Ag++CN-→AgCN AgCN+CN-→Ag(CN)-2
都是很完全的反应,它们的平衡常数分别为 1014 和 107。请设想,如果其中的一个反应不那么完全,那就要用过量试剂(相当于上实验中的 KCN)才能使
其较为完全。如果用图表示这样的实验结果时,将得到(从两边看来)“不对称”的线段。
现将 19 届国际化学奥林匹克的一道题及其答案列在下面,供读者参考。
例题 从一个含有 KCl 和 KCN 的中性溶液中取出 25.00ml ,用0.1000mol/lAgNO3 标准溶液进行电位滴定(温度,25℃,用银电极和甘汞电极,忽略 CN-和水液中 H+的结合),得到电位滴定的曲线如图 1-4 所示。
求①滴定过程中所发生的几个反应分别在 A、B、C 处达到终点。写出反应式。
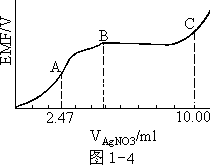 ②滴定到
B 点时需多少 ml 的 AgNO3 溶液。
②滴定到
B 点时需多少 ml 的 AgNO3 溶液。
③试液中 KCl、KCN 浓度各是多少?
④计算 A、B、C 处的电动势。
⑤C 点时溶液中 cCl-/cCN-的摩尔比是多少?
 数据φ
(Ag+/Ag)=0.800V,φ(甘汞)=0.285V,Kap(AgCN)=10-15.8 ,
Kap(AgCl)=10-9.75,β(Ag(CN)-2)=1021.1。
数据φ
(Ag+/Ag)=0.800V,φ(甘汞)=0.285V,Kap(AgCN)=10-15.8 ,
Kap(AgCl)=10-9.75,β(Ag(CN)-2)=1021.1。
解答①开始滴入 AgNO3,首先发生
Ag++2CN-—→Ag(CN)-2 (A)
接着 Ag+和 Ag(CN)-2 生成 AgCH
Ag(CN)-2+Ag+—→2AgCN (B)
继续滴入 AgNO3 生成 AgCl
Ag++Cl-—→AgCl (C)
②由(A、B)式知,B 点体积为 2×2.47=4.94ml
③cKCN=4.94×0.1000×1000/25.00=0.0198mol/l cKCl=(10.00—4.94)×0.1000×1000/25.00
=0.0202mol/l
④A 点电动势 0.047V,C 点电动势 0.277V(计算从略)。
⑤C 点溶液中 cCl-/cCN-=1.12×106,固体中 n(Agcl)/n(AgCN)
=1.02。
这里需要强调,即使对于较完全的反应,也应注意所用试剂的相应浓度。如 Al3+和 OH-反应生成 Al(OH)3 是极完全的反应,而 Al(OH)3 只能溶于一定浓度的 NaOH 溶液,即 Al(OH)3 溶于 OH- 不是一个完全的反应。现若用0.10mol/lNaOH 和同浓度 AlCl3 作用,当所用溶液体积 V(NaOH)/V(AlCl3)=3 时, Al(OH)3 沉淀完全。从另一方面看,只有加入稍大于 4 体积 NaOH 液于 1 体积AlCl3 溶液中(即 V(NaOH)/V(AlCl3)>4),Al(OH)3 才有可能完全溶解。若过量
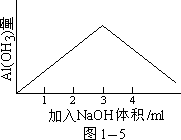 (0.05V)
,则 NaOH 在总体积(5.05V) 中的浓度为 0.05 × 0.10/5.05 ≈
0.001mol/l,pH=11。事实是在 PH=11 的溶液中,Al(OH)3
很难完全溶解。只有加入更过量的 NaOH,才能使 Al(OH)3 完全溶解(图 1-5)。
(0.05V)
,则 NaOH 在总体积(5.05V) 中的浓度为 0.05 × 0.10/5.05 ≈
0.001mol/l,pH=11。事实是在 PH=11 的溶液中,Al(OH)3
很难完全溶解。只有加入更过量的 NaOH,才能使 Al(OH)3 完全溶解(图 1-5)。
- 测定氨络铜(Ⅱ)络离子,Cu(NH3)2+ 中氨的配位数
实验 4 称取 0.5g 氨络铜(Ⅱ)盐溶于水,稀释成 200ml,从中吸取10.oml,然而用 0.020mol/lH2SO4 进行滴定。当滴入 4.6ml 和 9.5mlH2SO4 时, 溶液的 pH 值有显著的改变。
溶液 pH 值发生明显改变,表示在该处溶液中化学反应种类的改变,即在滴入 4.6ml 前溶液中发生了第一个反应,滴入 4.6—9.5ml 时发生了第二个反应,滴入超过 9.5ml 则发生第三个反应。
第一个反应只能是 H+和 Cu(NH3)2+ 间的反应。可以把加入 H SO 看成是NH3 浓度不断下降的过程,所以 Cu(NH3)2+ 转化为 Cu(OH)2。
Cu(NH3)2+ +(n—2)H++2H O→Cu(OH) +nNH+
第二个反应则应是 Cu(OH)2 溶解于 H2SO4(消耗 H2SO4 液体积为 9.5-4.6= 4.9ml)
Cu(OH)2+2H+→Cu2++2H2O
第三个“反应”是简入 H2SO4 导致 pH 下降的过程。
第一个反应消耗“(n-2)/2mol”H2SO4 的体积为 4.6ml,第二个反应消耗“1mol”H2SO4 的体积为 4.9ml,则
(n-2)/n=4.6/4.9
解得 n=3.88≈4
实验 5 (另一种测定氨配位数的方法)称取 0.5g 氨络铜(Ⅱ)盐溶于水,加 20.0ml0.50mol/lHCl(过量),用水稀释到 200ml。吸取 10ml 用水稀释到 50ml,用 0.050mol/lNaOH 液滴定。发现在加入 2.25ml 和 6.10ml 时溶液的 PH 值有明显的改变。据此可算出络合物中氢的配位数。
加 20.0ml0.50molHCl,而后用水稀释到 200ml,则 HCl 浓度为:20.0× 0.50/200=0.050mol/l,这个浓度和后面所加的 NaOH 浓度相同,因此其体积比即摩尔比的关系。
Cu(NH3)2+n 和过量 HCl 作用后,溶液中有 Cu2+、NH+4 及过量的 H+。滴入的 NaOH 首先与 H+中和,消耗 2.25ml(即过量 HCl 的体积);接着滴入的 NaOH 和 Cu2+生成 Cu(OH)2 沉淀,消耗了(6.10—2.25)=3.85ml,最后滴入的 OH- 和 NH+4 结合成 NH3·H2O 并与 Cu2+络合,消耗了(10.00—6.10)=3.90ml。
H++OH-→H2O 2.25ml Cu2++2OH-→Cu(OH)2 3.85ml
Cu(OH)2+(n-2)NH3+2NH+4→Cu(NH3)2+ +2H2O
3.90ml
n∶2=(10.00-2.25)∶(6.10-2.25)
n≈4,即为 Cu(NH3)2+4
