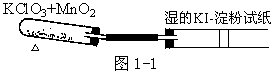
氯酸钾热分解反应
以 MnO 为催化剂催化 KClO 热分解①是实验室制备 O 的反应
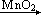 2KClO3
2KCl+3O2↑
2KClO3
2KCl+3O2↑
 1820
年 Doberenier 首次利用 MnO2 催化 KClO3 分解的方法制备 O2
气体。同时指出气体产物有异常的气味,当时曾认为是含 Cl2、O3
所致。证实气体产物中异物的一种实验装置如图 1—1 所示。
1820
年 Doberenier 首次利用 MnO2 催化 KClO3 分解的方法制备 O2
气体。同时指出气体产物有异常的气味,当时曾认为是含 Cl2、O3
所致。证实气体产物中异物的一种实验装置如图 1—1 所示。
已知一般情况下,O2 不可能氧化 KI,但在实验中湿的 KI-淀粉试纸却变色, 表明产物中必含有氧化性比 O2 强的物质。在 J.Chem.Educ.(美,化学教育) 上,1962 年、1963 年先后发表过 2 篇文章讨论 KClO3 的热分解产物。
实验 1 把热分解生成的气体导入水中,然后取出少量水溶液,用 HNO3 酸化并滴入 AgNO3 溶液,得白色沉淀。表示有 Cl-。
实验 2 使气体通过 KI 溶液,再用已知浓度的 Na2S2O3 溶液滴定生成的I2。表示含有氧化性的气体。根据 KClO3 用量及 Na2S2O3 消耗量知,KClO3(MnO2)热分解气态产物中含有<3%(体积)的非 O2 的氧化性气体;进而对气体进行质谱分析,得知其中含有 ClO2。
到目前为止,已确证 KClO3(MnO2) 热分解生成的气体中含有( 除 O2 外)Cl2、ClO2 及 HCl(文献中未列出各物的具体含量)。
化学上认为 KClO3(MnO2)的热分解是“极为完全的反应”。实验事实表明: “极完全反应”中尚且有“副反应”,可见,“完全的反应”并不见得是“唯一的反应”。也可以说,有副反应是化学反应的一个普遍特点。一般书上给出的是某化学作用的主要反应式,而不是全部反应式。需要强调,主要反应并不都是转化率很高的反应,也有转化率很低的主要反应。如,用 XeF2(二氟化氙)氧化 KBrO3 为 KBrO4 是目前制备 KBrO4 的一个有效的方法,但 KBrO3 的转化率仅为~20%。
XeF2+BrO-3+2OH-→Xe+BrO-4+2F-+H2O 为了加深副反应具有普遍性的印象,再举一个实例。
实验 3 把 AgNO3 液滴入 KBr 液中发生了主要反应的方程式为
Ag++Br-→AgBr↓
其副反应的方程式为
 AgBr+Br-
AgBr-2
AgBr+Br-
AgBr-2
生产感光胶片的一种方法,恰好是利用了生成溶解度略大(于 AgBr)的AgBr-2 的副反应,以加速(按上式进行的)沉淀溶解平衡,使 AgBr 颗粒较快地长大,并长得较有规则,以提高胶片的感光性能。
顺便把有关 KClO3(MnO2)热分解的资料介绍于后。
① 关于《氯酸钾催化热分解反应是怎样进行的》请参考:冯增嫒等,化学通报 9,43—45(1988)。
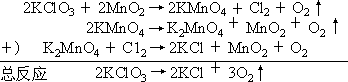 早期文献①认为
MnO 催化 KClO 热分解的历程
早期文献①认为
MnO 催化 KClO 热分解的历程
在实验中发现,把 1g KClO3 和<0.04g MnO2 混匀加热,在 KClO3 未完全分解前,冷却混合物并把它倒入冷水中,可观察到 MnO-4 的特征颜色(如加热“过了头”,就看不到紫红色)。
看到了特征的紫红色是否就证实了上述催化过程是正确,而且是唯一正确的呢?按说这个历程基于有MnO-4 和Cl2 存在提出的,大体说来是可信的(习惯上,不把可信的过程理解为唯一正确的历程,除非有确切的证据)。然而这个实验结果并不能排除,看到的紫红色是由“MnO2- ”(绿色)在水中发生自
氧化还原反应所生成的
3K2MnO4+2H2O→2KMnO4+MnO2↓+4KOH
- 曾试验过多种氧化物作为 KClO3
热分解反应的催化剂,并测定了它们(作为催化剂)的活化能
|
反应物组成 (1 ∶ 1) |
KClO3 + NiO |
KClO3 + NiO + 1%Li2O |
KClO3 + NiO + 1%Cr2O3 |
KClO3 + CuO |
|---|---|---|---|---|
|
分解温度/K 活化能 |
630 - 638 148.5 |
603 - 643 107.1 |
603 - 643 152.7 |
603 - 673 196.7 |
|
kJ · mol-1 |
||||
|
反应物组成 (1 : 1) |
KClO3 + MgO |
KClO3 + ZnO |
KClO3 + TiO2 |
|
|
分解温度/K 活化能 kJ · mol-1 |
738 - 773 219.7 |
733 - 773 200.0 |
733 - 773 198.7 |
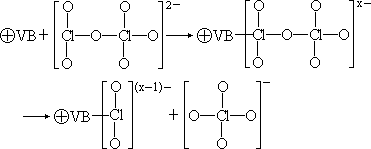
基于这些氧化物的结构,目前认为 p 型氧化物(NiO 和 CuO)的催化性能较强,n 型氧化物(ZnO、TiO2)和绝缘体(MgO)的催化性能较差。它们的催化机理是:
- p 型氧化物和氯酸根形成化学键(VB)MClO4 的分解温度高于 MClO3,但
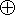 “ClO-2”盐却极易分解(式中
表示缺电子,x<2)。
“ClO-2”盐却极易分解(式中
表示缺电子,x<2)。
① 文献报道,加 0.2%(相当于 KClO3 质量)MnO2 作催化剂,将被 KClO3 氧化成 KMnO4。又,MnO2 作为催化剂,其活性取决于对它的预处理;若 MnO2 和 10%(MnO2 质量的 10%)Fe2O3 混合,则是比MnO2 更强的催化剂。
 n
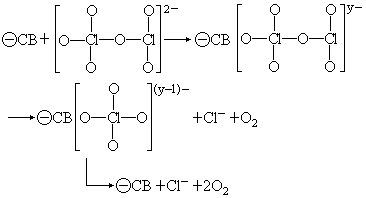
型氧化物催人是导带(CB)机理
n
型氧化物催人是导带(CB)机理
(式中 表示多电子,y>2)
这两种催化剂的不同点是反应始于催化剂和 ClO-3 中的 Cl 或 O 相连。显然,这两个机理比上述生成 KMnO4 中间物过程更进了一步。
