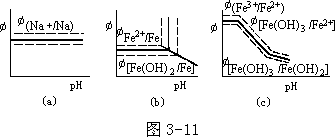
电极电势和 pH 关系图
水溶液中电极电势是各电对与标准氢电极电对的相对值,如Na++e-==Na φ=-2.7V
Fe2++2e-==Fe φ=-0.44V
Fe3++e-==Fe2+ φ=0.77V
电极电势(代数值)小的,其还原型(如 Na、Fe)是强还原剂;大的,其氧化型(如 Fe3+)是氧化剂。显然,改变氧化型物质或(和)还原型物质的浓度,将影响各电对的氧化还原性。对此问题,以改变 pH 对上述 3 个电对产生的影响为例来讨论。
例 现往以上 3 种电对中滴加浓 NaOH(为简化起见,忽略加 NaOH 前后溶液体积的改变)。
Na++e-==Na 电对。因 c(Na+)不会因 pH 增大发生改变,即其电对的电极电势值不受 pH 影响,在图中是一条平行于横坐标(pH)的直线;然而原先溶液中 c(Na+)的大小,将影响其电极电势值,图 3-11(a)中以虚线表示,c(Na+) 大的“线段”在下面。
Fe2++2e-==Fe 电对,随溶液 pH 增大,到 Fe(OH)2 开始沉淀以前,c(Fe2+)不随 pH 而变,表现为一条平行于横坐标(pH)的直线。从 Fe(OH)2 开始沉淀的pH 值起,随 pH 增大 c(Fe2+)下降,两者呈现反变的线型关系[图 3-11(b) 中虚线的含义同上]。
Fe3++e-==Fe2+电对,在Fe(OH)2 开始沉淀前的pH 范围内,c(Fe3+)、c(Fe2+)
 不随
pH 改变,表现为一条平行于横坐标(pH)的直线;从 Fe(OH)3 开始沉淀起到
Fe(OH)2 沉淀前的 pH 范围内,c(Fe3+)随 pH 增大而减小[而
c(Fe2+)不变],表现为反1涞南咝凸叵担淮覨 e(OH)2 开始沉淀的 pH 值起,随
pH 值增大,
不随
pH 改变,表现为一条平行于横坐标(pH)的直线;从 Fe(OH)3 开始沉淀起到
Fe(OH)2 沉淀前的 pH 范围内,c(Fe3+)随 pH 增大而减小[而
c(Fe2+)不变],表现为反1涞南咝凸叵担淮覨 e(OH)2 开始沉淀的 pH 值起,随
pH 值增大,
c(Fe2+)、c(Fe3+)均减小,表现为(斜率与前不同的)另一条呈现反变关系的直线[图 3-11(c)中虚线的含义同上,不另述]。
以上 3 个电对涉及的电极电势-pH 图中只有 3 种线段:(1)电极电势与pH 在一定范围内的(横坐标)无关,是一条有确定电极电势值的水平线;(2) 平行于纵坐标(电极电势值)的直线,表明它和确定的 pH 有关而和电极电势值无关,即 Fe(OH)2、Fe(OH)3 开始沉淀的 pH 值;(3)相应于氧化型物质或(和) 还原型物质浓度随 pH 值增大而减小的直线。其中(a)线的位置取决于氧化型和(或)还原型的浓度;(b)线取决于氧化型或还原型开始沉淀为 M(OH)n 的 pH 值(显然,开始沉淀 M(OH)n 的 pH 值也与 c(Mn+)有关);(c)直线斜率的大小取决于 M(OH)n 的 Ksp 及 n 值:Ksp 小的,在 pH 较小时就能沉出 M(OH)n;n 值大的,c(Mn+)随 pH 增大,下降得快(严格说来,还和得失电子数有关,不赘述)。
 图中线上的任一点都表示电对处于平衡态,线外的任一部位均非平衡态。如在电势高于
0.77V[如 c(Fe3+)=1.0mol/1]的 c)范围内,只能以 Fe3+ 存在;在 0.77V
时,溶液中Fe3+和等浓度 Fe2+成平衡;电势介于 0.77 和-0.44V 之间,只能以
Fe2+(如浓度为 1.0mol/1)存在;电势为-0.44V 时,Fe 和Fe2+(浓度为
图中线上的任一点都表示电对处于平衡态,线外的任一部位均非平衡态。如在电势高于
0.77V[如 c(Fe3+)=1.0mol/1]的 c)范围内,只能以 Fe3+ 存在;在 0.77V
时,溶液中Fe3+和等浓度 Fe2+成平衡;电势介于 0.77 和-0.44V 之间,只能以
Fe2+(如浓度为 1.0mol/1)存在;电势为-0.44V 时,Fe 和Fe2+(浓度为
- mol/1)平衡,若 c(Fe2+)≠1.0mol/1,其平衡态以水平虚线表示在图形之中。
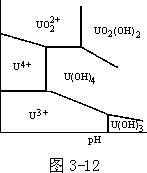
为了强调说明电极电势-pH 关系图中只有 3 种线段,图 3-12 列出铀的电极电势-pH 图(部分)及有关数据:U(OH)3、U(OH)4 的 Ksp 分别为 10-19、10-45。请读者说出此图中各线及各区的含义。
