3.8 学习图示的重要性
用平面坐标图示一个化学或物理过程,就线段走向而言有一定的规律(实际上是过程性能的反映)。因为线段走向有规律,可根据对实验的理解,在不同条件下进行有关实验并把实验结果(一个实验结果就是一个确定关系,即一个点)画在平面坐标内,再把这些点连结起来,就得相应图形。如求某物在 0
—100℃间的溶解度曲线,可按间隔为 10℃或 20℃测定其溶解度,在平面坐标上把这些点连接起来,即得溶解度曲线。这样可省去许多时间,不必测定每个温度下的溶解度。
作图的优越性还在于按连续线段走向“自然向外延伸”(术语:外延法) 去求那些不可能作的或作不准的数据。如弱电解质在溶液中只发生部分电离,其电离度随浓度减小而增大,可以想象,当弱电解质溶液浓度极低(如 c
→0)时,其电离度将趋近 100%。但随着浓度下降,浓度稀了,实验数据不易测定或测不准。利用外延法,即把 0.10、0.050、0.010⋯⋯mol/1 等尚能测准的实验
|
c(HAc)/(mo/1) |
0.10 |
1.0 × 10-2 |
1.0 × 10-3 |
1.0 × 10-4 |
3.6 × 10-5 |
|---|---|---|---|---|---|
|
W(HAc)/1 电离度a |
6.0g 0.013 |
0.60g 0.042 |
0.060g 0.13 |
6.0mg 0.35 |
2.2mg 0.50 |
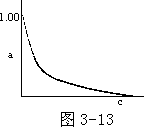 结果画在图上,并把它们连接起来,按连续线段走向自然外延到
c→0 处,可知其 a≈100%。
结果画在图上,并把它们连接起来,按连续线段走向自然外延到
c→0 处,可知其 a≈100%。
凝固点降低常数(Kf)是指在 lkg 溶剂中含有 1mol 非电解质溶质时,其凝固点低于纯溶剂凝固点的值。溶剂为 H2O、C6H6 时,其 Kf 分别为 1.86℃、5.4
℃。由 Kf 及稀溶液实际凝固点,可求得固态非电解质的摩尔质量。这种实验对稀溶液的数据较为可靠、准确;而当浓度达到 1mol/kg 时,已不是稀溶液了,实验数据不准。因此,要用外延法求“当浓度达到 1.0mol/kg 时的 Kf”。
众所周知:在标准状况下,1mol 气态物质的体积为 22.412 升。然而许多气体物质在标准状态下的摩尔体积不是此值(数据见下表)。22.412 升是按理想气体行为(气体分子的体积为零,相互间无作用力)才得到的。对于实际气体,(在 273.16K 条件下)压力
|
O2 |
H2 |
|||
|---|---|---|---|---|
|
p/atm |
pV |
p/atm |
pV |
|
|
实验值 |
1.00 |
22.393 |
1.00 |
22.423 |
|
(273.2K) |
0.500 |
22.403 |
0.500 |
22.417 |
|
0.250 |
22.408 |
0.250 |
22.414 |
|
|
外延值 |
→ 0 |
22.414 |
→ 0 |
22.412 |
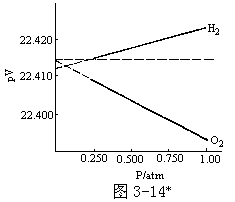 愈小,气体体积愈大。当压力小到一定程度,分子间相互作用力极弱,可忽略不计;分子体积和分子间平均距离相比,小到可以忽略不计。因此可按理想气体对待。然而压力小了,实验结果不准,所以要借助于外延法。
愈小,气体体积愈大。当压力小到一定程度,分子间相互作用力极弱,可忽略不计;分子体积和分子间平均距离相比,小到可以忽略不计。因此可按理想气体对待。然而压力小了,实验结果不准,所以要借助于外延法。
t
上面讨论了平面坐标上线段的特点(2 个变量间的确定关系)、坐标标度的选取、连续线段的走向等,这些都取决于化学或物理过程的特性,还介绍了外延法。最后还要讨论如何理解“连续”(显然,对于线型图形极易判定是否连续,不必讨论)。在许多情况下,线段的连续性是明显的,如 KNO3 的溶解度曲线,而 Na2SO4 溶解度曲线是由 2 条连续线段相交而成。后者实际上是两种纯物质 Na2SO4·10H2O、Na2SO4 各自的溶解度曲线。针对两种物质的溶解度曲线,不必讨论相互间是否连续的问题。
线段是否连续或相交,可由该处线段斜率有无“明显改变”来判断。在上述把 SO2 导入 H2S 溶液中,图形的前半部分,其—PH 逐渐升高并达接近 7.0, 均表示
SO2+2H2S→3S↓+2H2O
化学过程,该线段上各点的斜率均为正值(参与反应的 SO2 量和 pH 呈正变关系)。图形的后半段是 pH 值从 7.0 减小的过程,是 SO2 溶于水过程的 pH 值图示,线段上各点的斜率均为负值(SO2 量与 pH 呈反变关系)。就是说,该图是由 2 条相交、但分别代表 2 个化学过程的线段组成。图形和它相似的滴定曲
线,也是由 2 条相“交”但分别代表 2 个过程——中和作用与 c(NaOH)增大
——的线段所组成。
凡是在一条连续的线段上,各点斜率是“均匀改变”的。如 p-nNH3(mol)
%、T-nNH3(mol)%,纯水的 p-T 图,则该线只表明一个化学或物理过程。综上所述,可根据线段上各点斜率改变是否“均匀”判定该线段所表明
的是一个或若干个化学(或物理)的过程。如把 AgNO3 溶液滴入含 Cl-、CN-的
溶液,用银和甘汞电极测定其电动势(EMF/V)。实验结果列于图 3-15。图中
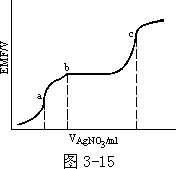 曲线表明在
a、b、c3
曲线表明在
a、b、c3
点处,其斜率均有明显的变化,即在滴入 AgNO3 溶液过程中共有 4 个和电动势有关的过程
|
a 点前 a—b 间 |
Ag++2CN-==Ag(CN)-2 Ag(CN)-2+Ag+==2AgCN↓ |
K=1.3×1021 K=3×106 |
|---|---|---|
|
b—c 间c 点后 |
Ag++Cl-==AgCl↓ Ag+浓度增大的过程 |
K=5.6×109 |
总之,可由线段上各点斜率是否均匀改变判断线段是否连续。
