2.9 几个具体问题
在以上各节讨论中,力求突出一、二种观点,但必有另外因素同时出现。这就从另一面说明:科学思维是一个整体,不能机械地把它隔裂开来。下面将就其些具体问题进行讨论。
(l)反应速度常数的内函由实验知道,反应
A+B→C
的速度首先取决于 A 和 B 分子间的互撞。设在一定温度下反应体系中有m 个 A 分子和 n 个 B 分子,每个 A 分子和 n 个 B 分子碰撞几率为 n 次,今有 m 个 A 分子,所以总的碰撞几率是 m×n 次。单位体积内有 m 个 A 分子,n 个 B 分子,即其浓度,以 c(A)、c(B)表示
v∝c(A),v∝c(B)
v∝c(A)c(B)
所以 v=kc(A)c(B)k 为比例常数,即反应速度常数。在一定温度下,当 c(A)、c(B)均为单位浓度时,即 c(A)=c(B)=1.0mol/l,则所测得的反应速度 v=k。
为进一步讨论速度常数的内函,现对比都能用相同的速度表达式表示其反应速度的若干个不同的反应。如在一定温度、压力下,A(气)和 B(气),C(气)和 D(气),E(气)和 F(气)的速度表达式分别为
v1=k1c(A)c(B),v2=k2c(C)c(D),v3=k3c(E)c(F) 在一定温度下,使
c(A)=c(B)=c(C)=c(D)=⋯
可以想象,此时 A 和 B 碰撞总几率相同于 C 和 D,E 和 F⋯⋯碰撞的总几率。然而这几个反应的速度不可能相同,其差值显然是这几个反应的速度常数不同的反映。可见,k 值是化学反应本质的一种表现(可认为碰撞是机械的因素,它未能很好揭示反应的本质)。那么,k 又是如何体现反应本质的呢?
例 1 HI 分解为 H2 和 I2 的反应。
2HI→H2+I2
反应的起码条件是 2 个 HI 分子间的互相碰撞。设今有 n 个 HI 分子,第 1 个HI 和其他 HI 碰撞(n-1)次,第 2 个 HI 和其余 HI 碰撞(n-2)次,第 3 个 HI 为(n-3)次⋯⋯,碰撞总次数按等差数列加和
项数( 首项+末项) / 2 = (n-1+1)(n-l) / 2 =
(n 很大,n-1≈n)
n(n − 1) n2
2 ≈ 2
单位体积内 n 个 HI 分子可用浓度,c(HI)表示,1/2 并入常数
v∝c2(HI) v=kc2(HI)
由计算知,773K、常压下 1 升中 HI 分子在 1 秒内互相碰撞的总几率是 3.5×
1028 次。如若每次碰撞都发生反应的话,则 3.5×1028 次相当于 5.8 ×
104mol/1·s,反应将于瞬间完成,然而实际反应速度是 1.2×10-8mol/l·s, 两者相差 1012 倍,表明分子间互撞只是发生反应的前提。目前已知,只有当2 个分子按下列方式互撞时才可能发生反应
H—I+I—H→H⋯I⋯I⋯H→H2+I2
H⋯I⋯I⋯H 表示在 H 和 I 尚有弱键合的情况下发生了 I⋯I 间的弱键合,把它叫做活化络合体。其能量比 2 个独立的 HI 分子要高,两者间的差值叫活化能,以 Ea 表示。即由 2mol 普通 HI 转化为 1molH⋯I⋯I⋯H 所需的最低能量就是 HI 分解反应的活化能。显然,Ea 的小大决定了速度的快慢。
k∝e-Ea/RT
式中 e 为自然对数,R 是气体常数,T 为绝对温度。对于不同的反应,均有相应的活化能。
现在再回头来讨论 HI 间的互撞,既可能是 H—I 与 H—I 碰,也可能是 H
—I 与 I—H 碰及其他各种部位互碰,其中按能发生反应要求的方向互撞(即 H
—I 和 I—H 碰撞)只是一小部分。统计看来,在一定温度下这一小部分该是一个定值。因为此值和碰撞方向有关,称为方位因子,以 A 表示。这个值(常以百分数表示)就包括在 k 值之内,即
k=Ae-Ea/RT
由上讨论可知,反应速度常数相当于比例常数,却包含着丰富的有关反应实质的内函,而了解其内函有助于对问题的深入理解。
(2)由化学反应确定物质的组成和结构
确定物质组成和结构的一种方法是:使其和某已知物反应,由实验结果判断物质的结构、组成。下面举几个实例。
例 2 用 NaOH 液滴定一定量聚磷酸,在消耗 42.0ml 和 50.0ml 处分别有2 个终点。求此种磷酸中平均含几个磷原子?
回答此问题需先讨论缩合含氧酸(聚酸)的结构和酸性的关系。聚磷酸从结构上看是磷酸脱水形成的
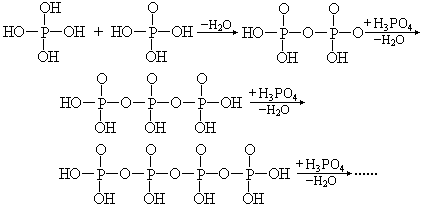
H3PO4 是三元酸,其 K1》K2》K3,聚磷酸是多元缩合酸,链中间的每个 P 原子只和 1 个 OH 相连,首末 2 个 P 原子各和 2 个 OH 相连。如四聚磷酸中有4 个 P 原子及和 6 个与之相连的 OH 基。H4P2O7 焦磷酸是四元酸,K1=3.0×10-2, K2=4.4×10-3,K3=2.5×10-9,K4=5.6×10-10,其 K1 与 K2 相差很小是因为分
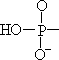 别从
2 个不同的 P—OH 键上断下 H+,K3、K4 则是从
别从
2 个不同的 P—OH 键上断下 H+,K3、K4 则是从
负性物上断下 H+,所以其值明显小。同理,在四聚磷酸中 K1、K2、K3、K4 值相近,而 K5、K6 较小。
其他多元含氧酸有类似情况,如酸中只有 1 个成酸元素原子,则 K1 与 K2 之间有明显差值;若有多个成酸元素原子,则 Kl 与 K2 等相近。如
酒石酸:K1=6.0×10-4,K2=1.6×10-5
柠檬酸:K1=7.4×10-4,K2=1.7×10-5,K3=4.0×10-7
乙二胺四乙酸:
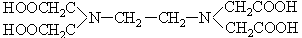
K1=1×10-2 K2=2.1×10-3 K3=6.9×10-7 K4=5.5×10-11
有了磷酸,多聚磷酸的电离常数及其相互间的差值,可估计用 NaOH 液滴定它们时所发生的现象。因 H3PO4 的 K1 明显大于 K2,且差值在 104 以上,则叫“单独滴定 H3PO4 中 1 个 H+(用甲基橙为指示剂);因 K2 与 K3 有明显差值, 所以可用 NaOH 把 H2PO-4 滴定到 HPO2- (酚酞为指示剂),也可以从 H3PO4 滴定到 HPO2- (酚酞指示剂)。焦磷酸 K 、K 相近,无法用 NaOH 液分别滴定 H P O
中第一、第二个 H+,但可以把第一、第二个 H+同时滴定。由此推论,对于含n 个 P 原子的多聚磷酸,其 K1、K2⋯Kn 相近,而 Kn》Kn+1,所以当用 NaOH 液滴定它们时,可“同时”滴定第 1、2⋯共 n 个质子,最后再中和第 n+1、n
+2 个质子。尽管多聚磷酸的链可长、可短(即 n 不同),但最后滴定的是首末端 P 原子上的 OH,只有 2 个是不会变的。按题意,滴定最后 2 个 OH 耗(50.0
-42.0=)8.0mlNaOH 液,即每个和 P 原子相连的 P—OH 耗 4.0ml 碱液,则 n 为 42.0/4.0=10.5(个磷原子)。
n=10.5,显然是由 n>10 的和 n≤10 的多聚磷酸组成的混合物。
例 3 确定氨的组成。由元素分析知,氨由氮和氢组成,其分子式可由下列实验测得:使干的氯气充满下管(图 2-4),活塞上端为敞口,其间充满浓氨水。打开塞子,使浓氨水滴入管内,直到反应终了(不再冒烟)为止。关上活塞,待管内温度恢复到原温,把带塞的管子倒置于水中,打开活塞令水进入管内,最终水浸满 2/3 管(这是 Hofmann 测定氨组成的方法)。
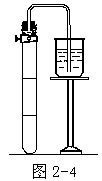
氨和 Cl2 发生剧烈反应生成的不溶于水的气体,只可能是 N2(最终充满1/3 管气体,绝不可能是 Cl2、NH3 及 HCl)。反应前后的温度、压力相同(忽略水蒸气压),Cl2 和 N2 的体积比为 3:1,符合此关系的反应方程式
1 氨+3Cl2→N2+nHCl
显然 n=6,即氨由 1 个 N 原子和 3 个 H 原子组成,分子式为 NH3。
说明:讨论时忽略常温下水蒸气压力,这是一种近似。常温(~293K)下,
饱和水气压约占常压(101325Pa)的 1/32。就是说,N2 的实际体积将比 1 大了
1 / 32,即V(Cl ):V(N ) = 3:1 1
,考虑时忽略这个值的1 / 32,不会影响到
2 2 32
对氨的组成推测。
例 4 确定氮的氧化物的组成。把铁丝置入一盛满无色氮的氧化物气体的瓶中,通电加热铁丝使之和气体反应。反应完毕,温度恢复到原温后,若:
①剩余气体的体积和原先气体的体积相同,②剩余气体体积是原先的一半。在上述两种情况下,原先瓶内各是何种氧化氮?
氧化氮和铁反应必是生成了氧化铁(强调反应消耗了氧,但无法确知生成物是何种氧化铁)和氮,N2。设原先无色氧化氮的组成为 NOx,则
①NOx+Fe→氧化铁+N2 原先无色气体为 N2O。
②NO
原先无色的气体是 NO。
+Fe→氧化铁+ 1 N 。
x 2 2
说明:因 NO2 是红棕色气体,所以被排除。那么,能否用这个方法测定NO2 的组成呢?方法同上,残余气体(N2)超过原先气体的一半量。这是因为在常温、常压下,二氧化氮是 NO2 和 N2O4 的混合体。
再次表明:用化学反应方法测定“组成单一”物质的组成是可能的。所谓组成单一包括只含极少量、微量其他物质的情况,如 NO 气体中含有极微量(NO)2。
例 5 确定臭氧的组成。取两试管体积相同的臭氧(O3)和 O2 的混合气, 分别倒置入水中,在一支试管水面上加少量松节油(此物能吸收 O3),气体体积缩小了 xcm3;对另一试管加热,使臭氧完全分解为氧,冷却到原温度后, 气体体积胀大了 x/2cm3(这是 Soret 测定臭氧组成的实验)。
松节油吸收臭气后体积减小了 xcm3,表明原混合气中含有 xcm3 臭氧(以On 表示);臭氧完全分解成 O2 体积胀大了 0.5xcm3,则
O → n O
n 2 2
由此可知 n=3,即臭氧分子式是 O3。
又,实验测知 O3 是弱极性分子(常见单质分子中唯一的一种极性分子)。此事实暗示,O3 中 3 个 O 原子并未排在一条直线上,而是弯曲形分子,即键角≠180°。
例 6 确定某未知物组成。把 SO2 导入 Cu(NH3)4SO4 至酸性,得一固态物
A。元素分析知 A 中含有:Cu、H、O、S、N 等 5 种元素,其中 Cu、N、S 的摩尔比为 1:1:1。A 为逆磁性物质,由结构分析知 A 中含有一个三角锥构型和一个四面体构型物质;使 A 和 H2SO4 反应得极细粉状物 B,释出气体 C,得到溶液 D。确定 A、B、C 各为何物?
把 SO2 通入 Cu(NH3)4SO4,除发生酸碱中和反应外,还发生了氧化还原反应。即三角锥 NH3 转变为四面体 NH+4,SO2 被转化为 SO2-4(四面体)、SO2-3(三角锥),Cu(Ⅱ)被还原为 Cu(Ⅰ)。
A 是逆磁性物,表明其中含 Cu(Ⅰ)。又因 A 中含 Cu、S、N 各 1mol,故其组成中含 Cu(Ⅰ)、NH+4、SO2- ,它的化学式是 CuNH SO 或(NH ) SO ·Cu SO 。
A 和足量 H2SO4 反应将生成 SO2(C)及 Cu(B)[后者是 Cu(Ⅰ),岐化为 Cu 和 Cu(Ⅱ)中的一个产物]。
例 7 根据化学反应确定硫酸的结构式。虽然近代的物理方法可以相当
准确地测定分子中各原子的排列、距离(健长)等数据。下面介绍在物理测量方法建立以前,化学家是如何以化学性质解决分子结构基本问题的,以硫酸为例。
氯气和浓硫酸化合生成 HSO3—Cl(氯磺酸),这是一个 Cl 置换 OH 的典型反应。又,PCl5 和浓硫酸反应生成 Cl—SO2—Cl(硫酰氯),后者和 H2O 形成HO—SO2—OH。结论是:硫酸中含有 2 个可被替换的 OH。又,硫酸中的 H 可被 Na、K、CH3、C2H5 等替换,但是只能得到一种 C2H5O—SO2—OK。由此得到第二个结论是:这 2 个 OH 是等同的(若不等同,应能得到两种不同的C2H5OSO2OK)。有些基团,如 C2H5、C6H5 能够替换 Cl—SO2—Cl、Cl—SO2—OH 中的 Cl,生成 C6H5SO2C6H5、C2H5SO2OH,而这些化合物可从氧化 C2H5SH、(C6H5)2S得到。在后两个化合物中 S 是直接和 C6H5、C2H5 连着的,故此得到第三个结论是:硫酸中的 2 个 OH 是直接和 S 相连的。再者,在反应中,硫酸中从未显示含有 O2- 的性质。第四个结论是:其余 2 个 O 原子间未发生结合,由常识
可知,这 2 个 O 原子只能和 S 原子相连。由上述 4 个结论可知,硫酸的结构是
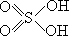
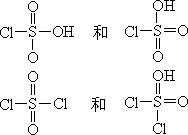 顺便提及,只有一种
HOSO2Cl、ClSO2Cl,表示其为立体的结构。若是平面结构,则将有 2 种
HOSO2Cl、ClSO2Cl,即
顺便提及,只有一种
HOSO2Cl、ClSO2Cl,表示其为立体的结构。若是平面结构,则将有 2 种
HOSO2Cl、ClSO2Cl,即
