归纳法
从有关事物中归纳其共同性得出相应的规律、观点、理论,就是归纳法。归纳过程往往是不断完善规律的过程。
许多老科学家认为:国内教学对归纳法注意不够,而归纳法往往是发现某些新规律的起点。李政道教授根据自己在国内和国外所受的教育,曾不止一次提出:国内教学上应注意归纳法。
本节将以水解反应为例进行讨论。
物质和水发生复分解是水解反应①,如
CaO+H2O→Ca2++2OH- CH3COO-+H2O→CH3COOH+OH- NH+4+H2O→NH3·H2O+H+
NH+4+CH3COO-+H2O→CH3COOH+NH3·H2O RCONH2+H2O→RCOOH+NH3(或 RCOONH+4)
C12H22O11+H2O→C6H12O6+C6H12O6
其中前 4 个反应发生在离子和水之间;后两者是由于在水分子进攻下,原先的 C—N、C—O 共价键断裂并和水中 H+、OH-结合。水解反应的共同点是:原化合物中的“正性”①(显然包括阳离子)部分和水中 OH-结合,“负性”①(包括阴离子)部分和水中 H+结合。
为了便于归纳,先讨论氯化物的水解(因 HCl 是强酸,所以可认为氯化物中的“Cl”不发生水解)。除了氯在和氟、氧、氮的化合物中显正性,水解产物中含正氧化态的氯化合物外
ClF5+3H2O→HClO3+5HF Cl2O+H2O→2HOCl NCl3+3H2O→NH3+3HOCl
氯在其他化合物中均显负性,所以在归纳氯化物水解时不必考虑“Cl-”的水解,即只要考虑氯化物中正性部分的水解就可以了。
TiCl4、SiCl4、无水 AlCl3、PCl5⋯⋯等氯化物在空气中冒烟,就是它们发生水解作用之故。水解产物之一受热(水解释热)挥发和空气中水气结合
MCl4+(n+2)H2O→MO2·nH2O+4HCl↑(M=Si、Ti)
AlCl3+3H2O→Al(OH)3+3HCl↑ PCl5+4H2O→H3PO4+5HCl↑
呈现冒烟。顺便提及,无水 Al2(SO4)3 水解作用不如无水 AlCl3 明显,可见水解 反应的现象还应和负性部分性质,如 HCl 易挥发有关。
</ZSBJ2T000045_0113_0/ZSBJ> ①
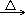 按照正性部分和水中
OH-结合能力由弱到强,其产物依次为碱式盐、氢氧化物、含氧酸,某些情况下可生成酸酐。
按照正性部分和水中
OH-结合能力由弱到强,其产物依次为碱式盐、氢氧化物、含氧酸,某些情况下可生成酸酐。
MgCl2+H2O Mg(OH)Cl+HCl↑
① 按说 NaH+H2O→NaOH+H2 也应归属于水解反应,但它不是本节所要讨论的内容。
① 若把水解定义为:“阴、阳离子和水发生复分解反应,”则不能包括最后两个实例;若定义为:“在水进攻下发生复分解反应”,则包括了后两个事实。
AlCl3→Al(OH)Cl2→Al(OH)2Cl→Al(OH)3 BCl3+3H2O→H3BO3+3HCl↑
SCl4+2H2O→SO2+4HCl↑ COCl2+H2O→CO2↑+2HCl↑
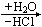 根据氯化物中阳性部分水解由弱到强,水解反应通式为
根据氯化物中阳性部分水解由弱到强,水解反应通式为
ACln A(OH)Cln-1
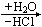 A(OH)aCln-a
A(OH)aCln-a
A(OH)n 或 HnAOn
(有时为 Aon/2)
此通式适用于 A 的可溶性强酸盐,如溴化物、碘化物、高氯酸盐的水解。由A 组成的弱酸盐,因负性部分也发生水解,产物种类可能会更多。
把上述通式用于氯化物水解时,有无“例外”?有,而且还有不少。那么,如何理解这个水解反应的通式呢?下面逐个进行讨论。
- 有时因水量不同,得不同的产物
如 PCl3 和过量水作用的产物是 H3PO3 和 HCl,其反应式为PCl3+3H2O→H3PO3+3HCl↑
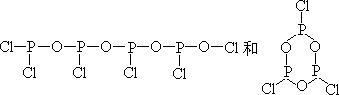 若
PCl3 和限量的水反应,则有
若
PCl3 和限量的水反应,则有
生成。前者可被看成是 2molP(OH)2Cl 和 2molP(OH)Cl2“作用脱去 3molH2O”;后者可被认为是 3molP(OH)2Cl 脱去 3mol 水的产物。而 P(OH)Cl2、P(OH)2Cl 是 PCl3 第一步、第二步水解的中间产物。当水量稍多时产物为 H3PO3 和H4P2O5(后者可被看成是 2molH3PO3 脱去 1mol 水的产物)。此例表明:某些物质水解产物因水量而异。对于氯化物而言,水少时,Cl 未脱尽,水量不足得到了相当于含 OH 物质脱水的产物。中间产物若能继续水解(如 POCl3),则在遇水时继续反应,生成最终产物(如 H3PO4);若中间物不能发生水解,则中间物就是最终产物(如 SbOCl)。
PCl5+H2O→2HCl+POCl3
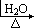 SbCl3+H2O→SbOCl+2HCl
SnCl2+H2O→Sn(OH)Cl+HCl IF7+H2O→IOF5+2HF↑
SbCl3+H2O→SbOCl+2HCl
SnCl2+H2O→Sn(OH)Cl+HCl IF7+H2O→IOF5+2HF↑
H3PO4+HCl
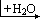 继续水解
继续水解
有鉴于此,在运用以上归纳得到的通式时,还要注意有时会出现因水量不同而生成不同产物的情况。
- 水解产物的稳定性
NCl3 水解性质已如前述。按说应得到 NH3 和 HOCl,但实际产物中常杂有N2 和 HCl(受热时更甚)。后两者是 NCl3“初级”水解产物间互相发生氧化还
原反应生成的。这类发生在两种水解产物间的氧化还原反应的实例并不多。但另一种情况,一种水解产物发生自氧化还原反应则是常见的。问题是水解产物在该条件下是否稳定。如前例提及 SCl4 水解产物 SO2 和 HCl,在实验条件下是稳定的,而且两者可以“相安无事”,所以是最终产物。与此相似, SeCl4、TeCl4 水解产物是 H2SeO3、TeO2 及 HCl。
SCl2 水解的“原先产物”应是 HCl 和不稳定的 S(OH)2,后者将发生自氧化还原反应生成硫氧化态>2+和<2+的化合物;同理,Se2Cl2 水解的“原先”产物为 HCl 和 Se2(OH)2,后者将发生自氧化还原反应得到氧化态高(> 1)、低(<1)的两种硒化合物。电子得失数在 Se2(OH)2 分子内部是平衡的。
2Se2Cl2+H2O→3Se+H2SeO3+4HCl↑
这个复杂的反应可被看成是在水解反应通式上加上了一个“Se2+ ”的自氧化还原反应。
2“Se2+ ”→3Se+“Se4+”
按说 S2Cl2 水解反应的产物也应是 S 和 H2SO3,但因含 S—S 键的化合物比较稳定,所以产物种类比 Se2Cl2 的多。
P2Cl4 的水解产物应是 HCl 和不稳定的 P2(OH)4,后者岐化为等摩尔 H3PO2和 H3PO2
P2Cl4+5H2O→H3PO2+H3PO3+4HCl↑
然而在 P2Cl4 水解产物中还有少量 P2H4(目前认为,生成 P2H4 和 P2Cl4 中的 P—P 键有关,但还不能完全解释清楚)。
改变温度可能导致某些反应进行或被抑制。按说 PCl3 和过量冷水生成
H3PO4 和 HCl。在受热的条件下,H3PO3 发生自氧化还原反应生成 H3PO4 和 PH3, 即 PCl3 在热时水解产物为 H3PO4、H3PO3、PH3 及 HCl。
归纳以上事实可知:按水解反应通式判断产物时尚需注意水解产物相互间(或某种水解产物)的氧化还原反应。
- 水解反应的机理
上述 SiCl4、TiCl4 都极易水解,那么和硅同族的碳的氯化物,如 CCl4 是否也容易水解呢?又,在 CF4 中因 F-也易水解,则 CF4 水解倾向将强于CCl4?然而实验事实是,常温下 CCl4 不水解,而 CF4 即使和 KOH 在一起加热到 673K,也不发生明显的水解反应。这是为什么?又,PCl5 水解时可以看到有无色油状物沉于底部,此油状物(为 POCl3)以后又会逐渐消失。看来,必须得注意水解反应的机理。
PCl5 完全水解,在有水参与下需脱去 5 个 Cl。由反应动力学知,反应过
程往往是逐步进行的,而不可能是 1 个 PCl5 同时和 5 个 H2O 分子碰撞在一起发生六分子反应。PCl5 水解过程可能是
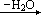 PCl5
PCl5
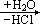 P(OH)Cl4
P(OH)Cl4
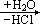 P(OH)2Cl3
POCl3
P(OH)2Cl3
POCl3
(油状物)
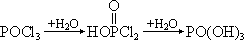 POCl3
继续和 H2O 反应,油状物消失。其机理为
POCl3
继续和 H2O 反应,油状物消失。其机理为
脱去最后 2 个 Cl 原子的反应速度都很快,几乎是同时进行的。
实验现象提示:要注意水解反应的动力学过程,而前面归纳得到的水解反应通式是基于热力学、化学平衡所得到的结论。水解反应速度较慢的有许多许多,如前述 NCl3 的水解作用。
 CF4
不易水解(由热力学看,CF4 的水解反应极为完全:CF4+2H2O=CO2 + 4HF 的
K~1023),而 SiCl4 极易水解均和动力学过程有关。
CF4
不易水解(由热力学看,CF4 的水解反应极为完全:CF4+2H2O=CO2 + 4HF 的
K~1023),而 SiCl4 极易水解均和动力学过程有关。
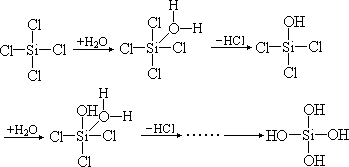
水分子中氧上的孤对电子进入硅原子的 3d 轨道①,而后脱去 1 个 HCl;又有1 个水分子进入,再脱去 1 个 HCl⋯⋯最终生成 Si(OH)4。碳是第二周期元素, 只能以 2s、2p 轨道成键,在四卤化碳中其轨道已经被占满了,没有空轨道来接纳水分子中的孤对电子。因此,如果它要发生水解反应只能先断 1 根碳— 卤键,然后再和水反应。事实上,C—F、C—Cl 键都比较牢固,尤其是 C—F 键特别强,不易断裂,所以很难发生水解反应。
- 把氯化物水解规律推广至其他化合物
现在进一步讨论,是否可将氯化物水解作用归纳得出的启示和结论用于其他化合物?溴化物、碘化物的水解反应大体上和氯化物相同,只是 Br-、I- 更易被氧化及某些溴化物、碘化物溶解度较小,所以水解反应及产物较为复杂。如 PI3 水解,按说“只能”生成 H3PO3 和 HI,但在水解产物中发现了少量 PH3 及含 P—P 键的化合物。幸好这些情况并不多。
氟化物水解 氟化物水解有 3 个特点:在所有的氟化物中氟均显负性, 水解生成 HF;HF 不是强酸,所以氟化物水解倾向将强于相应的氯化物(化学平衡观点)。因 A—F 键更稳定、更牢固,所以其水解反应的速度往往慢于相应氯化物;对于某些氟化物,F-是强配位体,发生络合作用。
SiF4 水解反应的速度比 SiCl4 慢了许多,而且不完全,因为水解产物 HF 将和 SiF4 配位成常温下不易水解的 H2SiF6
SiF4+2H2O→SiO2+4HF SiF4+2HF→H2SiF6
同理,BF3 的水解反应速度比 BCl3 慢(BCl3 在空气中冒烟),水解反应因生成 HBF4 而不完全
4BF3+3H2O→H3BO3+3HBF4
在 SF6 中,硫原子中可被利用的轨道均被占用了,没有空轨道接纳来自
① 证明 Si(Ⅳ)化合物水解时,有 H2O 进入 d 轨道的实例是■在前一个四面体中 CH3、C2H5、C6H5 按逆时针方向排列,而在后一个四面体中三者按顺时针方向排列,顺序颠倒了。由此可证,过程中 H2O 曾进入硅原子的轨道——d 轨道。
水分子中的孤对电子,所以要先断开 S—F 键。由于 S—F 健很强,不易断裂, 所以水解速度很慢,慢到可忽略不计的程度。
对氟化物水解反应的讨论表明:推广、运用一个规律时应充分注意其特殊性。否则推论、判断的结果往往是靠不住的。即使推论和实验事实相符, 但也可能有其特殊性。CF4、SF6 相同,实际上不水解,其速度可视为“零”, 但硫的饱和轨道数为 6,而碳是 4。
氧化物的水解 氧化物中的 O2-有很强的水解能力,所以碱性氧化物, 酸性氧化物均能和 H2O 生成碱、酸。
CaO+H2O→Ca(OH)2 SO3+H2O→H2SO4
不溶性氧化物,如 SiO2 除外。Cl2O 水解产物不稳定⋯⋯
硫化物水解 按说硫化物中的 S2-具有强的水解能力,所以硫化物水解倾向明显强于相应元素的氯化物。Na2S、CaS 在水中发生明显的水解作用, Al2S3 完全水解为 Al(OH)3 和 H2S[室温下,AlCl3 的水解不至于完全到全部转化成 Al(OH)3]。这就是硫化物水解的特殊性(与氯化物相比)。
CuS、SnS 等均为难溶物,一般不讨论其水解性,而 CuCl2、SnCl2 等水解很明显。这样就提出了一个问题,如何理解一般不讨论其水解性?是不水解, 还是水解反应可以忽略?此前未讨论过难溶卤化物、难溶氧化物,如 CaF2 、AgCl、AgBr、AgI 及 A12O3、TiO2,虽然其中有些化合物溶解了的部分水解反应极为完全。如溶解了的 ZnO,其 O2-完全和水成 OH-;溶解了的 SnS,S2-“完全”水解。不过因为溶解度大小,所以未予讨论。
显然,上述水解反应通式主要用来讨论可溶性的化合物。
其他化合物的水解 氮化物、磷比物水解生成 NH3、PH3 和相应的金属氢氧化物或氧化物
Mg3N2+6H2O→3Mg(OH)2+2NH3↑
Zn3P2+6H2O→3Zn(OH)2+2PH3↑
(粮食仓库中利用 Zn3P2 和空气中水气生成有毒的 PH3,因而被用作杀虫剂。) 由前述水解反应通式可以想象到,若水解产物是稳定的,则生成物简单,
很好判断;若产物之一不稳定,则生成物物种较多。因此,在一定程度上可
根据水解产物是否“单一”①来推论原化合物的结构。Mg N 水解生成 Mg(OH) 和“单一”的 NH3,可知原化合物中有“N3-”;Al4C3 水解生成 Al(OH)3 和单一的 CH4,可见原物中有“C4-”;电石,CaC2 中有“C2- ”,所以它水解形成Ca(OH)2 和单一的 C2H2。若水解产物种类较多,很可能是原物不纯,水解产物不稳定(或两者兼而有之)或原物组成比较复杂。为此,讨论以下几种类型的化合物。
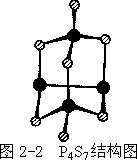
磷的重要硫化物有 P4S3、P4S7 及 P4S10。其中 P4S10 和 P4O10 相当,其水解
产物均为 H3PO4(其他还有 H2S);而 P4S7 和 P4S3 则不然,水解产物中含磷的物种甚多:P4S3 水解产物中有 PH3、H3PO2、H3PO3、H3PO4,P4S7 水解生成 PH3、H3PO2、H3PO3、H3PO4。这是因为在 P4S3、P4S7 中磷的氧化态不止一种,其结
① 在此处用“单一”,是为了强调,不要、也不应该把它理解为 100%。
构中含 P—P 键之故。
含“C4-”的碳化物水解生成 CH4,如 Be2C、Al4C3;含“C2- ”的 M2C2(M 为金属,如 Ca、Ag)水解生成 C2H2(因 Ag2C2,Cu2C2 等是难溶物,一般不讨论其水解反应);含有“C4- ”的是 Mg C ,水解反应式为
(C=C=C)C4-+4H+→H2C=C=CH2 或 H3C—C≡CH
(水中)
此种产物不稳定,将分解为 CH4、C2H2⋯⋯(相当于 C3H4 自氧化还原反应,在分子内部电子得失是平衡的)。
由于物质化学式及其结构间没有必然的联系,所以不能简单地根据物质
的化学式来判断其生成物。如说不清 Fe3C 中 Fe、C 的氧化态,它溶于酸生成(除含铁化合物外):H2(75%),CH4(15%),C2H6(6%),痕量高级碳氢化合物。又如,ThC2 和水、2mol/lNaOH 反应的产物物种甚多(下表),可见原化合物中碳的结构比较复杂。
金属氮化物、磷化物、碳化物、硅化物、硼化物和酸反应,生成物中有如此多的物种,一个原因是由于这些化合物的结构比较复杂;另一方面是由于它们的水解产物,如 SiH4、B2H6 等很容易转化为其他硅氢化物、硼氢化物。按说 Mg2Si、Mg3B2 与酸反应将生成“单一的”SiH4、B2H6,实际上 Mg2Si 和酸(HCl)反应的收率很低,在生成的气态产物中含 SiH4(40%)、Si2H6(30%)、
Si3H8(15%)、Si4H10(10%)、高级硅氢化物(5%)及 H2。如 Mg2Si 和浓 H3PO4 反应,则收率较高(因在和 HCI 作用时,生成物 SiH4 将和 H2O 继续反应)。Mg3B2 和酸反应的(产物按 B2H6 计)收率不足理论值的 1%,水解产物中有 B2H6 、B4H10⋯⋯这是因为 B2H6 易转化为 B6H11、B4H10⋯⋯之故。其实前述的某些卤化物,水解也生成多种物种。如氟化氙 XeF2、XeF4、XeF6 水解反应方程式
2XeF2+2H2O→2Xe+O2+4HF
3XeF4+6H2O→Xe+2XeO3+12HF XeF6+H2O→XeOF4+2HF
2XeF6+4Na++160OH-→Na4XeO6+Xe+O2+12F-
(高氙酸钠) +8H2O
以上产物(除 F-、H2O 外)均可被看成是正氧化态氙化合物不稳定,或氧化 H2O(生成 O2),或(和)发生了自氧化还原反应。某些碳化物(如 ThC2)的结构比较复杂,氧化态不明确,很难估计其水解产物(然而反应中电子得失均衡则是确定无疑的)。
总之,前述水解反应的结论,原则上适用于卤化物、氧化物、硫化物⋯⋯ 等的水解反应。
上述水解反应的规律是否也适用于和 H2O 类似、含质子的溶剂(如 H2O 是H—OH,NH3 是 H—NH2,C2H5OH 是 H—OC2H5)呢?可以适用,其区别仅仅是水解时和-OH 相连,变为和-NH2、-OC2H5 相连。如 P4O10 结构中有 6 根 P—O
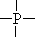
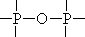 —P
键,1
个
—P
键,1
个 键和 1 分子 H2O 生成 2 个 OH,现在是 1 个与 1 个 NH3、C2H5OH 反应生成
1 个 OH
和
键和 1 分子 H2O 生成 2 个 OH,现在是 1 个与 1 个 NH3、C2H5OH 反应生成
1 个 OH
和 1
个 NH2、
1
个 NH2、
OC2H5⋯。再如,PCl5 在各种含质子溶剂中的溶剂解反应式为
PCl5+H2O→POCl3+2HCl PCl5+ROH→POCl3+RCl+HCl
从另一方面看,含氧酸中的 OH 和 H2O 中 OH 相当,因此也能发生醋酸解、硫酸解反应。其反应式如下
PCl5+CH3COOH→POCl3+CH3COCl+HCl
PCl5+SO2(OH)2→POC13+ClSO3H+HCl
由本节讨论可知:开始归纳部分事实得出的规律在继续归纳时使规律更充实,认识过程就是这样循序前进的。想只从少数几个实例中归纳得到普遍适用的规律是不可能的,但也不是说必须归纳成千上万事实才能得到在一定条件下基本适用的规律。正确的思维可以缩短认识具体事物的过程。另一方面,认识是有层次的,在某一层次上归纳得到大体上说来还适用的规律,但在更深的层次上可能还会发现更有趣、更深入的规律。
