“布丁模型”和“行星模型”
然而,原子的这种类似太阳系的内部结构并不是一开始就被确立起来的。1897 年,英国物理学家汤姆生(JosephJohn Thomson)通过演示在真空管放电时,阴极所发出的粒子可以被电场所偏转,从而确定了人类认识到的最早的几种粒子之一——电子的存在。
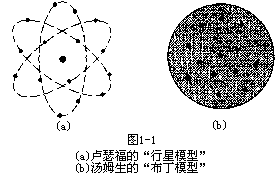
到了 20 世纪初,人们通过许多实验的结果已经认识到原子并不是不可再分的,在一定条件下原子会放出电子。因此,原子应当是由电子和与电子电量中和的带正电的部分构成的。当时汤姆生认为正电荷在原子中均匀分布, 而电子则散布在其中,被称为原子结构的“布丁模型”(见图 1-1)。与此同时,来自新西兰的英国物理学家卢瑟福(Ernest Rutherford)利用 a 粒子
(氦的原子核,带两个单位正电荷,质量约为 4 个原子单位,即约为质子的
4 倍)去轰击金属箔做成的靶。a 粒子带正电,当它射入到原子内部时,由于与原子中带正电的部分和电子之间存在的库仑力的共同作用,会产生散射, 使它在射出原子时方向偏离原来的入射方向。如果原子内部的正电荷像汤姆生所认为的那样是均匀地分布在原子内部的,那么通过计算可以证明,散射的角度,即 a 粒子的出射方向与入射方向之间的夹角是很小的。若要达到 1
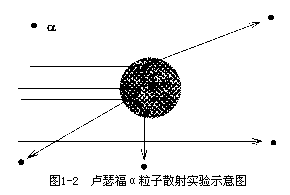
°左右的偏转角度,a 粒子在金属箔中前进时必须与金属原子碰撞许多次; 而要达到 90°左右的散射角的几率几乎等于零。然而,卢瑟福的实验显示出a 粒子通过金属靶时的大角度的散射的几率远远大于汤姆生模型给出的结果,甚至存在有的 a 粒子的散射角度达到了 180°左右(见图 1-2 所示的示
意图),而这对于“布丁模型”来说几乎是不可能的。就好像高射炮的炮弹打中了蚊子后被弹回来了。据此,卢瑟福提出了原子结构的另外一个模型, “行星模型”(见图 1-1)。他认为原子核虽然包含了几乎全部的原
子质量,但它所占有的体积却是原子中很小的一部分; 原子核处于原子的中心,而电子就像行星环绕太阳一样环绕带正电的原子核运动。“行星模型”的最重要的意义是揭示了原子内部的核式结构。在此基础上,逐渐发展成我们今天所熟知的原子结构的图象。
