§4 氢原子光谱
第三个问题是氢原子光谱的规律。
不同颜色的光之间的差别是它们的频率不同,可见光的频率从小到大是红、橙、黄、绿、青、蓝、紫,白光则是这七种颜色光的混合,光谱就是指光的强度按频率的分布情况。用各种不同元素的蒸汽充实制作的光源发出的是该种元素的特征光线,各种元素发的光线并不相同,钠光是黄色的,汞光则是青白色的,各种元素的光谱是识别该元素的特征。各种元素的光谱都不是连续光谱而是分立的线光谱,到 1885 年时人们已经在可见光和近紫外光谱
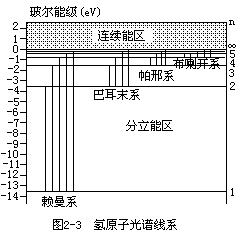
区观察到了氢原子的 14 条光谱线,波长最长的一条是红线,以后各条谱线的强度和谱线间的间隔都随频率的增加而递减,其中可见光的范围内有四条。 1884~1885 年,瑞士巴塞尔女子中学教师兼巴塞尔大学讲师巴耳末
(Johann Jakob Balmer)提出了氢原子光谱波长的经验公式
1 4 1 1
Ζ = B 22
− n2
n = 3,4,5 Λ
公式中只有一个经验参数 B=3645.6 埃,参数 n=3,4,5,6⋯,就精确
地给出了氢原子光谱各谱线的波长值,这个光谱线系后来称为巴耳末系(见图 2-3)。1889 年瑞典物理学家里德伯(Johannes Robert Rydberg)给出了一个氢原子光谱各谱线波长普遍的公式
1 = R
1 − 1
Ζ H m2
n2
这个公式中仍只有一个经验常数 RH=4/B,但出现两个正整数参数 m 和 n,其中 n 要大于 m.m=2 的光谱线就是位于从可见光到紫外线区域的巴耳末系光谱线;m=1 的光谱线位于紫外线区,1914 年由赖曼(Theodore Lyman)所发现,称为赖曼系;m=3 的光谱线位于红外线区,1908 年由帕邢(Friedrich Paschen)所发现,称为帕邢系;m=4 的光谱线位于近红外区,称为布喇开
(F.Brackett)系(见图 2-3);m=5 的光谱线位于远红外区,称为芬德
(H.A.Pfund)系;m=6 的光谱线位于远红外区,称为汉弗莱(C.S.Humphreys) 系。里德伯公式普遍概括了氢原子光谱线的分布,它给出氢原子光谱的任何一条谱线的波数都是两个“光谱项”之差,光谱项等于里德伯常数被一个正
整数的平方去除,而各光谱项的差别仅在于正整数所取的值不同,这个普遍的经验公式为探索氢原子结构提供了启示和基础。
按经典物理学的观念,电荷或电流的振荡就会发射电磁波。实验显示所有的原子光谱都是线光谱,这表明原子内部电荷应该可以作相应频率的振荡。在可以产生振荡的力学系统中,除了有基本频率的振荡外,常常还可以发生倍频振荡。然而在各种元素的原子光谱中,尽管有很强的规律性,但并没有观察到倍频光谱线。这表明在经典物理学的基础上很难理解原子光谱显示的规律性。
