无机物制备的方法
- 高温合成
用于高温反应的电炉主要有 3 种:马福炉、坩埚炉和管式炉(见第 1 章)。马福炉用于不需控制气氛,只需加热坩埚里的物料的情况。坩埚炉和管式炉通常用在控制气氛下(如在氢气流或氮气流中)加热物质,关于用管式炉进行合成反应可参看实验 31。
- 电解合成
利用通电发生氧化还原反应进行制备的方法。用于制备氧化性或还原性较强的物质。如 Na 和 K 等活泼金属、过硫酸盐、高锰酸盐、氟、钛和钒的低价化合物等。
由 K2MnO4 制备 KMnO4 可用电解法完成。阳极为镍片,阴极为铁丝,其总面积约为阳极的 1/25。在 60℃时电解 K2MnO4 溶液。控制阳极电流密度为10mA/cm2,阴极电流密度为 250mA/cm2,槽电压为 2.5~3.0V。阴极有气体放出,KMnO4 在阳极逐渐析出沉于槽底。两极反应:
阳极:MnO2- —e→MnO-
4 4
阴极:2H2O+2e→2OH-+H2↑
- 静电放电合成
利用气体在外界强电场影响下产生等离子体的方法制备热力学上不稳定的物质,放电合成可在放电管中进行。臭氧发生器便是一种放电管,主要用处是从氧制备臭氧。
- 光化学合成
有时化学反应只有在反应物受到光照射时才能进行。光子使反应物活化,反应物吸收光子后,成键或非键轨道上的电子被激发到反键轨道上,导致键的削弱甚至断裂,使反应活化。本法用于合成羰基化合物、硼化物等。如:将五羰基合铁的冰醋酸溶液暴露在日光或紫外灯下,发生下面的反应:
2Fe(CO)5→Fe2(CO)9+CO
再如:三氯化硼和氧的光化学反应:
BCl hv→ BCl + Cl
BCl+O2→BClO2 BClO2+BCl→2BOCl 3BOCl→(BOCl)3
另外,一硝基五氨合钴(Ⅲ)配离子CO(NH ) NO2+ ,暴露在日光或
紫外光中,能转变成相应的亚硝酸根五氨合钴(Ⅲ)配离子[Co(NH3)5ONO]2+。
- 化学传输合成
此方法是利用化学反应将难挥发物质从某一个温度区域传输到另一个温度区域的方法。常用的传输剂有氢、氧、氯、碘、一氧化碳、氯化氢等。化学传输反应在反应炉中两个不同的温区进行,先将所需要的物质(固体)与适当的气体介质在源区温度(T2)反应,形成一种气态化合物,然后借助载气把这种气态化合物传输到不同温度(T1)的沉积区发生逆向反应,使得所需物质重新沉积出来,如:
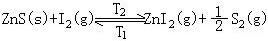
- 非水溶剂合成
适用于制备反应物或产物与水起反应的物质。常用的非水溶剂有:氨、冰醋酸、硫酸、氟化氢,如钾的氨溶液与氧作用制备超氧化钾 KO2,即为非水溶剂合成。
- 沉淀合成
这是一般无机合成中常用的方法。将欲制备的化合物以沉淀形式从其他化合物中分离出来,如氢氧化铝的制备:
Al2(SO4)3+6NH3·H2O→2Al(OH)3↓+3(NH4)2SO4
有时不能一步反应得到所需的化合物,先用沉淀法得到一种化合物,再
用其他反应处理此化合物,得到所需物质,如:从碳酸氢铵和氯化钠制备碳酸钠:
 NH4HCO3+NaCl→NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
NH4HCO3+NaCl→NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
除上述 7 种方法外,还有其它方法,如:气相色谱法,化学真空系统法
等。
- 无机物的提纯方法
- 重结晶
方法如下所示:
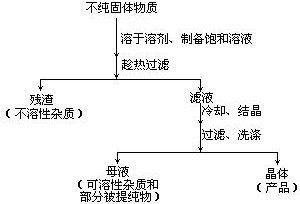
不难看出,在重结晶的过程中将要损失一部分被提纯物质。这是重结晶法不可避免的缺点。若需进一步提高纯度可再作一次重结晶,称为二次重结晶。
- 蒸馏
是提纯液体物质的一种方法。它是利用液体混合物中各组分挥发性的不同,将它们分离的方法。液体的挥发性与其沸点有关。液体的沸点低,容易挥发,即挥发度大;沸点高的难挥发,即挥发度小。当加热液体混合物,其蒸气中容易挥发的物质含量较多,而在剩余的液体中则难挥发组分的含量较高。将蒸气冷凝后,则易挥发组分富集在冷凝液中。这样,便将液体混合物中各组分部分地或全部分离。通过一次普通蒸馏,一般只能做到部分分离。为了达到较彻底分离,就要进行多次重复蒸馏。在每一次重复中,都可得到进一步的纯化。
蒸馏方法有许多种,下面介绍 3 种: 1)常压蒸馏
被蒸馏的物质受热后不发生分解或其沸点不太高,则可在常压下进行蒸馏。其实验装置比较简单,如图 5-1 所示。加热方法取决于被蒸馏物质的性质及沸点。如果沸点低于 90℃,就用水浴加热;若超过此温度,应当用油浴、沙浴或盐浴等;若被蒸馏物不易爆炸或燃烧,可用电炉或火焰灯加热。
- 减压蒸馏
若常压蒸馏容易使蒸馏物质分解或物质的沸点很高,可采用减压蒸馏或真空蒸馏。其装置(如图 5-2 所示)要复杂一些,而且气密性要好。
- 分馏分馏是将液体混合物在一定的设备内同时进行多次部分气化和部分冷凝,从中提取纯物质的蒸馏过程。分馏又称为分级蒸馏或精馏。这种方法适用于可以互溶而且沸点相差很小的两种以上的液体所组成的混合液。
在实验室,分馏过程通常是在分馏柱(或称分凝器)内进行的。其装置如图 5-3 所示。当蒸馏出来的混合蒸气进入分馏柱后,挥发度小的物质的蒸气在还未达到顶部时就冷凝为液体,又流回蒸馏瓶里。挥发度大的物质的蒸气一直上升到顶部,进入冷凝管。这样,只要控制不同的温度,便可将各种物质分离。
- 化学迁移反应
在高温下呈挥发性化合物转移物质的反应叫做迁移反应。用迁移反应提纯物质的原理,可通过下述实例加以说明。将被提纯物质 A,例如镍,放入安瓿中(如图 5-4),在安瓿中有一定浓度的气体载体(卤素、氧气、水蒸气等),在本例中载体为一氧化碳。气体载体在加热时,与被纯化物质起反应形成挥发性物质,而且这一物质依靠扩散作用转移至具有不同温度的安瓿的另一端,在这一端发生被扩散物质的分解作用。在所述实例中, 50~80
℃(T1)一氧化碳与镍反应,形成羰基化物 Ni(CO)4:
 Ni+4CO
Ni(CO)4+Q
Ni+4CO
Ni(CO)4+Q
安瓿的另一端温度是 180~200℃(T2 ),四羰基合镍会发生分解作用, 析出纯净的镍,也就是平衡移向相反方向。
- 升华
固体物质受热不经过液体阶段,直接变成气体的现象称为升华。冷凝升华的物质,便可得到纯物质。升华分为常压升华和真空升华。后者主要用于难升华物质,如金属的纯制。升华操作是将欲纯化的固体物质和冷凝器密封在石英管或陶瓷管中(也可置于坩埚内,再放至管中),受热后,升华的物质便沉积在冷凝器表面。固体碘便可用升华的方法进行纯化。
除了上述方法外还有许多其他提纯物质的方法,如:萃取法、色层法、重力分离法等。
