二、氢气的实验室制法
 科学家是从金属跟稀硫酸反应中发现氢气的。直到现在实验室里仍然用
科学家是从金属跟稀硫酸反应中发现氢气的。直到现在实验室里仍然用
金属锌跟稀硫酸反应来制取氢气。
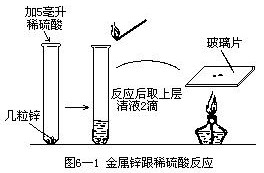
〔实验 6—1〕按图 6—1 做锌跟稀硫酸反应的实验,观察现象并做记录。
|
实验内容 |
现象 |
结论 |
|---|---|---|
|
1.往锌粒中加稀硫酸。 |
有 生成。 |
金属锌与稀硫酸反应,可以制取 ,同时还有 生成。 |
|
2.燃着的木条靠近试管 口。 |
看到 , 听到 。 |
|
|
3.将试管中的澄清液滴2 滴到玻璃片上,加热蒸干。 |
有 出现。 |
在上面实验中可以看到,试管里有无色气体生成,点燃时产生火焰,它就是氢气。反应后的溶液经过蒸发,得到白色的固体,它是硫酸锌(ZnSO4)。这个反应可以用化学方程式表示如下:
Zn+H2SO4(稀)=ZnSO4+H2↑
除金属锌外,是否还可以用其它金属跟稀硫酸反应制取氢气呢?
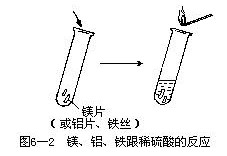
〔实验 6—2〕取三支试管,按图 6—2 分别做金属镁、铝、铁跟稀硫酸反应的实验,观察现象并做记录。
·镁跟稀硫酸反应,产生 ,点火能 。
·铝跟稀硫酸反应,产生 ,点火能 。
·铁跟稀硫酸反应,产生 ,点火能 。
实验证明,金属镁、铝和铁等金属均可以跟稀硫酸反应,放出氢气。其它的酸跟这些金属反应是否也能生成氢气?
〔实验 6—3〕用稀盐酸代替稀硫酸跟金属锌反应,观察现象。实验证明,用盐酸代替稀硫酸跟锌反应同样能生成氢气。
上述实验说明,实验室里可以用锌、铁、镁、铝等金属跟稀硫酸或盐酸起反应来制取氢气。
实验室制取少量氢气,常采用图 6—3 的装置。
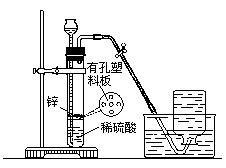
在这个装置中,锌粒放在多孔塑料隔板上,平常与酸液不接触。当需要氢气时,打开橡皮导管上的弹簧夹,酸即从长颈漏斗流下,与锌粒接触,发生反应,产生的氢气从导管导出。如不再需要氢气时,就用弹簧夹把橡皮导
管夹紧,试管内氢气的压强增大,把酸液压回到长颈漏斗里,使锌粒与酸液脱离接触,反应就自行停止了。
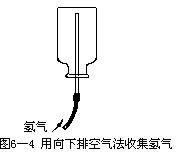
由于氢气难溶于水,所以可用排水法收集;又由于氢气比空气轻,也可用向下排空气法收集(见图 6—4)。为了防止氢气逸散,充满氢气的集气瓶必须口朝下放置。