§5—1 核外电子排布的初步知识
电子在原子核外以很高的速度不停地运动着。电子运动不像行星绕太阳旋转有固定的轨道,但却有经常出现的区域。科学家把这些区域称为电子层。电子层离核的远近与电子具有的能量有关。如果一个原子具有多个电子,则这些电子的能量不完全相同。能量低的电子在离核近的电子层上运动,能量高的在离核远的电子层上运动。我们可以根据电子层离核由近及远的顺序把它们编号,并分别以英文字母表示:电子层 一 二 三 四 五 六 七
英文字母表示 K L M N O P Q 电子能量 低────────→高离核距离 近────────→远
核外电子的分层运动,又叫核外电子的分层排布。经科学研究证明,核电荷数从 1~18 的元素和 6 种稀有气体元素原子的电子层排布情况,如表 5
—1 和 5—2 所表示的那样。
表 5—1 部分元素原子的电子层排布
|
核电荷数 |
元素名称 |
元素符号 |
各电子层的电子数 |
|---|---|---|---|
|
K L M |
|||
| 1 | 氢 | H |
1 |
| 2 | 氦 |
He |
2 |
| 3 | 锂 |
Li |
2 1 |
| 4 | 铍 |
Be |
2 2 |
| 5 | 硼 | B |
2 3 |
| 6 | 碳 | C |
2 4 |
| 7 | 氮 | N |
2 5 |
| 8 | 氧 | O |
2 6 |
| 9 | 氟 | F |
2 7 |
|
10 |
氖 |
Ne |
2 8 |
|
11 |
钠 |
Na |
2 8 1 |
|
12 |
镁 |
Mg |
2 8 2 |
|
13 |
铝 |
Al |
2 8 3 |
|
14 |
硅 |
Si |
2 8 4 |
|---|---|---|---|
|
15 |
磷 |
P |
2 8 5 |
|
16 |
硫 |
S |
2 8 6 |
|
17 |
氯 |
Cl |
2 8 7 |
|
18 |
氩 |
Ar |
2 8 8 |
表 5—2 稀有气体元素原子的电子层排布
|
核电荷数 |
元素名称 |
元素符号 |
各电子层的电子数 |
|---|---|---|---|
|
K L M N O P |
|||
|
2 |
氦 |
He |
2 |
|
10 |
氖 |
Ne |
2 8 |
|
18 |
氩 |
Ar |
2 8 8 |
|
36 |
氪 |
Kr |
2 8 18 8 |
|
54 |
氙 |
Xe |
2 8 18 18 8 |
|
86 |
氡 |
Rn |
2 8 18 32 188 |
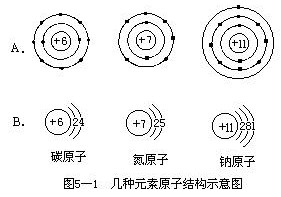
当我们知道了元素的核电荷数和电子层排布之后,就可以用原子结构示意图把一种元素的原子结构简明形象地表示出来。图 5—1A 是几种元素的原
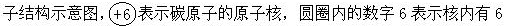
个质子,核外的圆圈表示电子层,圆圈上的黑点表示电子层上的电子。由于画圆圈、打黑点比较麻烦,通常就把它们简化,把圆圈改画为弧线,电子数用数字标在弧线上(见图 5—1B)。这两种表示方法都叫做原子结构示意图。
讨论 从表 5—1、5—2 中你能否看出,稀有气体元素,金属元素和非金属元素的原子最外层电子数目各有什么特点?
表 5—3 原子电子层结构的特征与变化趋势
|
元素种类 |
最外电子层电子的数目 |
在化学反应中原子电子层结构变化的趋势 |
|---|---|---|
|
稀有气体元素 金属元素 非金属元素 |
8 个( He 为 2 个) 一般少于 4 个 一般多于 4 个 |
不易与其它物质发生化学反应,原子电子层结构不易变化,故称为相对稳定结构。 易失电子,使次外层变成最外层,达到 8 电子(对于只剩下 K 层的原子是达到 2 电子)相对稳定结构。 易得电子,使最外层达到 8 电子(对于只有 K 层的原子是达到 2 电子)相对 稳定结构。 |
元素的性质与原子核外电子的排布,特别是最外层上的电子数目有密切的关系。
元素在化学反应中,如果原子易失电子,就说这种元素具有金属性;如果原子易得电子,就说这种元素具有非金属性;如果原子既难失去电子,又
难得到电子,即元素原子的电子层结构难以变化,就说这种元素具有化学惰性。
