怎样培养学生的思维能力
一、关于思维能力
思维是认识过程的高级阶段,是人脑对事物本质和事物之间规律性关系的反映。思维能力是培养学生各种能力的核心。化学学科的丰富内容非常有利于培养学生分析、综合、抽象、概括的能力,有利于培养他们对事物进行对比、类比、判断、推理以及跨越时空的想象力。要学好化学学科,无论是学习理论,掌握化学知识,解答习题,应用知识,自始至终都存在着积极的思维活动。因此,思维能力的培养对学生当前的学习和未来的发展均有十分重要意义。
一般认为能力可分为:
记忆力
观察力 直观形象思维
思维力 抽象逻辑思维
这些结合形成运用能力,
想象力 直觉(创造)思维 包括分析问题和解决问题
操作、运算
实践能力组织、设计
自觉能力
能力,又称迁移能力
其中,抽象逻辑思维包括抽象思维能力和逻辑思维能力。抽象思维能力指实现由直观的感性的认识到抽象的、理性的认识飞跃的思维。在化学中,从观察和实验中取得大量的感性材料之后,经过“去粗取精、去伪存真、由此及彼、由表及里”的改造,以抽出事物的本质属性,认识化学现象的内在联系(如化学概念的形成)。逻辑思维能力指概念的判断、推理、论证等基本的思维形式和归纳与演绎、分析与综合、比较与分类等常用的思维方法。
二、如何培养学生的思维能力
(一)按照由感性—理性—感性的认识规律进行教学
 在初中化学介绍原子的概念时,首先演示氧化汞受热分解的实验。将橙红色的氧化汞进行加热,在试管壁上出现具有金属光泽、银白色的物质,聚集后成为液体,同时还产生能使木条余烬复燃的气体。前者是汞(水银)、后者是氧气。记录如下:
在初中化学介绍原子的概念时,首先演示氧化汞受热分解的实验。将橙红色的氧化汞进行加热,在试管壁上出现具有金属光泽、银白色的物质,聚集后成为液体,同时还产生能使木条余烬复燃的气体。前者是汞(水银)、后者是氧气。记录如下:
其次,进行分析与讨论:
- 氧化汞是由什么微粒构成的?它有什么特征?
(氧化汞是由氧化汞分子构成的。氧化汞分子保持着氧化汞的化学性质。氧化汞分子之间有间隔且在不停地运动着。)
- 受热后氧化汞生成两种物质,汞和氧气。说明氧化汞分子是由什么微粒构成的?
(氧化汞分子是由更小的汞微粒和氧微粒所构成。)
- 汞微粒和氧微粒称为原子,根据上述实验事实,原子在化学反应中有什么特点?
(分子可以分成原子,原子不能再分。)
- 根据原子在化学反应中的特点总结出什么叫原子?
(原子是化学反应中不能再分的最小微粒。)
-
此时,介绍每个氧化汞分子分解成一个汞原子和一个氧原子后,汞原子组合成金属汞;每两个氧原子组合成一个氧分子而形成氧气。
-
图解。
第三,引导学生运用原子、分子的概念解决实际问题
图 37
-
从以上分析、讨论得出原子的概念,再通过有关化学史的介绍, 概括出原子-分子论。进一步说明,随着科学技术的迅速发展,对原子、分子的认识已越来越深入。为介绍原子结构的初步知识作好了准备。
-
提问:硫在加热的条件下,在氧气中燃烧生成有刺激性气味的气体二氧化硫。如何用原子-分子观点进行解释呢?
(硫是由硫分子构成,氧气由氧分子构成在加热的条件下,它们的分子破裂,其原子进行重新组合,每一个硫原子和两个氧原子生成一个二氧化硫的分子。)
- 概括:如果反应物和生成物均是由分子构成的物质。如何用原子-分子的观点认识这类化学反应的实质?
(分子破裂、原子重新组合,生成新物质的新分子。)
(二)按照逻辑思维的方法进行教学
下面以初中化学“化合价”一节的教学为例进行说明。
[提问回忆]
-
用电子式表示 NaCl 和 CaCl2 的生成过程。
-
用电子式表示 HCl(气)和 H2O 的生成过程。
(以上两题不作考查要求,为形成概念作好准备)
-
叙述Na、Mg、Al、Si、P、S、Cl、C、O、F
原子最外层电子/TITLE>数各是多少?
-
什么叫离子化合物和共价化合物?
以上问题的目的,既是复习巩固前一节的基础知识又是为学习化合价的概念及确定作好知识的准备。
[讨论推断]
(l)为什么一个 Na 原子和一个 Cl 原子互相结合?(因为 Na 原子最外层有一个电子; Cl 原子最外层有七个电子,所以一个 Na 原子和一个 Cl 原子可通过失、得一个电子,而使它们分别达到稳定结构。)
- 为什么一个 Ca 原子和二个 Cl 原子互相结合?(因为 Ca 原子最外层有二个电子;Cl 原子最外层有七个电子,所以每一个 Ca 原子和二个 Cl 原子通过失、得两个电子,而使 Ca 原子和每个 Cl 原子达到稳定结
构。)
-
为什么一个 H 原子和一个 Cl 原子互相结合?(因为 H 原子最外层有一个电子;Cl 原子最外层有七个电子,所以一个 H 原子和一个 Cl 原子通过共用一对电子,可使 H 原子和 Cl 原子均达到稳定结构。共用电子对偏向 Cl 原子。)
-
为什么一个 O 原子和二个 H 原子互相结合?(因为一个 O 原子最外层有六个电子;一个 H 原子最外层有一个电子,所以一个 O 原子和两个 H 原子,通过共用两对电子(偏向 O 原子)使 O 原子和每个 H 原子均达到稳定结构。)
[比较分析]
通过上面讨论、引导、点拨得到解答后,提出,上面四个问题的解答中原子在互相结合时,不管通过什么方式有哪些共同的特点?
此时,可充分让学生讨论。适时,可由学生或教师总结、概括。原子互相结合时,不论通过什么方式,总是要达到稳定的结构,由于每种原子最外层电子数是固定的,它们得失或共用的电子对数目也是固定的。所以,原子互相结合时,必然会有一定的数目,这个性质叫元素的化合价。什么叫元素的化合价?
[总结概括]
此时,首先让学生看本节课本第一段,然后由学生默述定义。[质疑应用]
问:离子化合物中元素化合价的数值是如何确定的?
举例:一个 Na 原子失去—个电子为+ 1 价;一个 Cl 原子结合一个电子为-1 价。
回答:
- Mg 和 Cl 结合时的化合价数值各是多少?为什么?结合时原子个数各是多少?
(一个 Mg 原子化合价为+2 价,因为结合时它失去两个电子;一个Cl 原子化合价为-1 价,因为结合时它得到一个电子。结合时是一个 Mg 原子和两个 Cl 原子。)
-
Al 和 F 结合时的化合价数值各是多少?为什么?结合时原子个数各是多少?
-
Na 和 S 结合时的化合价数值各是多少?为什么?结合时原子个数各是多少?
-
Al 和 O 结合时的化合价数值各是多少?为什么?结合时原子个数各是多少?
(2—4 题的答题思路与 1 题相同。)
通过应用既可巩固概念,又可为引出新的概念作好事实准备。[分析综合]
在上面的实例中,金属原子的化合价如何确定?非金属原子的化合价如何确定?
(一个金属原子失去几个电子,就是正几价;一个非金属原子结合几个电子,就是负几价。)
在离子化合物中元素(包括金属和非金属元素)的化合价如何确定? 请进行分析总结。其中元素化合价的数值,正价总数与负价总数之间的
关系是什么?
[抽象概括]
经过学生回答、教师点拨,最后得出离子化合物中元素化合价数值的确定及化合价的法则。
按照离子化合物中元素化合价数值确定的教学程序,进行共价化合物中元素化合价数值确定的教学。下面只介绍教学中所提的问题。
(1)H 和 F 结合时,化合价各是多少?为什么?结合时原子个数各是多少?
(2)H 和 S 结合时,化合价各是多少?为什么?结合时原子个数各是多少?
(3)H 和 N 结合时,化合价各是多少?为什么?结合时原子个数各是多少?
(4)C 和 O 结合时化合价各是多少?为什么?结合时原子个数各是多少?
在让学生回答之前仍要举例说明:
如:H 和 Cl 结合时共用一对电子,所以一个 H 原子和一个 Cl 原子的化合价均为 1 价。由于共用电子对偏向 Cl 原子,所以,一个 H 原子为+1 价;一个 Cl 原子为-1 价。
关于化合价的应用这里就不介绍了。
(三)进行综合启发式教学
现以“原电池”概念的教学为例进行说明。
[引言]原电池从字意来看是产生电流的装置。电流是如何产生的? 也就是原电池的原理是什么?原电池形成的条件是什么?怎样解决这些问题呢?仍然遵照认识源于实践的道理,首先进行实验。
[实验]和[分析]
- 将锌片和铜丝分别放入盛有稀硫酸的试管中进行观察。(可以边讲边试;也可用投影仪观察实验现象)
(锌片上产生气泡且不断溶解,铜丝上无变化。)
让学生回答原因后,叙述离子方程式及电子转移方向和总数。
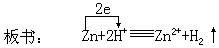
- 将上述两个试管中的锌片和铜丝用导线相连接后,观察有什么现象?
(和前面的实验现象相同。)
- 将锌片和铜丝放在盛有稀硫酸的同一烧杯中,并用导线将锌片和铜丝连接后,进行观察。
(铜丝上产生气泡,锌片不断溶解而损耗。)
让学生进行解释原因后,写出产生变化的离子方程式。
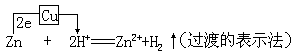
质疑:既然锌原子将 2 个电子转移到铜,2 个氢离子自铜上结合 2 个电子形成氢分子。那么在锌和铜之间一定有电流产生。这种判断正确吗?
- 装置和(3)相同,只是在锌和铜之间串接一个电流计,让学生观察现象。
(电流计指针偏转)
有电流产生。电流的方向如何?
- 取一干电池。用电流计的正极接碳棒;负极接锌皮(第 4 个实验用电流计正极接铜;负极接锌片。)接通后让学生观察。
(电流计指针偏转且方向与铜锌原电池偏转的方向相同。)
小结:由于干电池的碳棒是正极,所以铜锌原电池中的铜也是正极。由于干电池的锌皮是负极,所以铜锌原电池的锌为负极。电流方向由铜到锌,电子流方向由锌到铜。
此时,写出电极方程式:
Zn(负极)Zn-2e=Zn2+(氧化)——阳极Cu(正极)2H++2e=H2↑(还原)——阴极
质疑:锌、铜两种金属在电解质溶液中相连接可以产生电流。其它金属等导体在相同的条件下是否也能产生电流呢?
- 分别用铁、铜;铁、石墨碳棒,在稀硫酸中相连接,中间串以电流计进行观察。
(电流计指针偏转,并进一步确定电流方向和电极的极别。)
小结:两种活动性不同的金属或非金属在电解质溶液中相连接,有电流产生。
[讨论]
-
组成原电池的条件是什么?也就是发生原电池反应的条件是什么?
-
原电池的原理是什么?也就是原电池为什么能产生电流?
-
原电池的能量变化是什么?此时,让学生阅读课本内容后进行回答。学生在回答时进行疏导和指导以得出正确的结论。最后总结为:
-
两块活动性不同的金属或非金属等导体在电解质溶液中相联接,则发生原电池反应,有电流产生。
-
原电池的原理是阳、阴两极发生氧化、还原反应,失、得电子的同时,外电路有电子作定向移动而产生电流。
-
原电池是由化学能转化成电能的装置。
(四)按照自然科学方法论的途径和步骤进行教学
所谓在教学中运用自然科学方法论的途径和步骤,就是引导学生依照下面的程序进行学习。
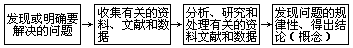
不过要根据教材的实际和学生的情况灵活运用上述过程。现初中化学“水”的一节教学为例介绍如下。
质疑:如何认识水的分子组成?
- 首先要做好电解水的演示实验。引导学生观察和记录实验现象。得出:
阴极产生氢气;阳极产生氧气,其体积之比为 2∶1。
 按下面的程序进行分析和研究科学方法
按下面的程序进行分析和研究科学方法
认识过程
实验事实 数据变换
体积比2∶1
感性
质量比2×0.089∶ 1×1.43 = 1∶8
数据分析
思维活动
综合和
结 论
水分子中氢、氧原子质量比1∶8
1 8
水分子中氢、氧原子个数比 ∶
= 1∶05 = 2∶1
1
理性经测定水的分子量为
水分子中氢、氧原子数目为
16
18
2和1
表示方法
H 2 O(分子式)
- 具体的教学过程
①在演示、观察现象、写出化学反应式后,提问:通过实验说明水这种物质是由什么元素所组成?接问:水,氢气,氧气各属哪类物质? 为什么?用分子、原子的观点解释原因。
(水是由氢、氧两种元素所组成。水是化合物,氢气、氧气是单质。原因是:水分子是由不同种的氢原子和氧原子所组成,氢气分子、氧气分子分别由两个氢原子、两个氧原子所组成。)
②写出氢气与氧气的体积比为 2∶1 后,问:其质量比是多少?
(2×0.09∶1×1.43=1∶8)
接问:水中氢元素与氧元素的质量比是多少?为什么?
(也是 1∶8,因为符合质量守恒定律。)这样,由生成物氢气和氧气的质量比,根据质量守恒定律转换成水的宏观组成氢元素与氧元素的质量比。
③讨论:一个水分子中,氢原子与氧原子的质量比是多少?为什么?
(也是 1∶8,由于水是由同种分子所组成。)这样,由水的宏观组成转换成水的微观组成。
④讨论:一个水分子中氢原子与氧原子的个数比是多少?
此时,进行启发。如果已知水的分子式为 H2O,其中氢原子与氧原子
的个数比为 2∶1。那么,氢原子与氧原子的质量比为: 2×1(H 的原子量)∶1×16(0 的原子量)
|
= |
2 |
∶ |
16 |
|---|---|---|---|
|
= |
1 |
∶ |
8 |
根据以上过程,怎样由氢原子与氧原子的质量比求其个数比呢?得出:氢原子与氧原子的个数比等于它们所占质量份数分别除以原子量后,
所得的数值之比。具体计算为:原子个数比 = 1 ∶ 8
1 16
= 2∶1
这样,由氢、氧原子的原子质量比转换成原子个数比。
⑤提出:一个水分子中氢氧原子个数比为 2∶1,其具体个数是多少呢?
讲解:水分子中氢原子与氧原子可以 2 和 1,也可以是 4 和 2 等都符合 2∶1 的要求。我们知道了什么量就可以解决这个问题?通过引导而得出:要知道水的分子量后,就可以解决这个问题。此时介绍,经过实验测定水的分子量为 18,据此水分子中含有 2 个氢原子和 1 个氧原子。这样由氢、氧原子的个数比转换成具体个数。
⑥提出:如何将这个实验、分析、讨论的结果记录下来呢?经回答后,得出:使用化学用语。分子式为 H2O。告诉同学我们认识了水的分子组成而得出结论。
