怎样进行化学习题教学
化学习题教学是将学生应当掌握的化学教材内容以问题的形式,通过课堂答问和练习、课外作业和测试等方式进行的教学活动。它以信息反馈为特征,了解和评价学生的学习质量和水平,具有及时了解教师教学效果的功能。
化学习题教学是化学教学不可缺少的组成部分。科学地实施化学习题教学,对加深学生对所学知识、技能的理解与掌握,对发展他们的思维能力与表达能力,具有十分重要的作用。
当前,化学习题教学存在的主要问题是:很多学生的课业负担过重, 挫伤了学生做作业和学习化学的积极性,影响了学生素质的全面发展; 一部分教师对学生解题缺乏指导或不善于指导,导致解题与落实知识、技能及培养智能脱节,影响了化学教学质量的提高。
因此,有必要对化学习题教学的基本要求,习题教学的一般过程, 以及对一些重要题型的解题方法进行认真的研讨。
一、化学习题教学的基本要求
-
教师要有目的、有计划、由浅入深地布置数量适当、富有启发性的化学习题,以调动并保持好学生学习化学的积极性。
-
为使学生全面掌握基础知识和基本技能,在使用习题时,要注意习题的多样性、综合性和适度的灵活性,并控制习题的数量。
-
教师要重视解题的示范,加强各类典型例题的指导,使学生懂得解各类题的基本思路、过程、格式与方法。通过适当的练习培养和巩固学生审题、析题的能力。
-
严格要求学生独立完成作业,培养学生对习题进行自我检查的习惯。
二、化学习题教学的一般过程
(一)创设积极思维的情景
教师要紧密结合所教的知识、技能,适时地提出要求学生解答的习题或实际课题,吸引学生思考。如果习题的难度大,综合性较强,教师可以用恰当的质疑问难的提问,对学生的思维进行启示、引导,使学生处于积极思考而又未搞通,整理思维准备表达而又不知怎样确切表达的状态,产生解题的强烈愿望。
(二)指导学生认真读题、审题、析题
这是完成解题的基础。学生往往不会或者不去认真读题、审题、析题,就忙于着手解答。因此,指导好读题、审题、析题是培养学生解题能力和完成解题的关键。
读题——要求学生认真阅读化学习题。复杂的题目,更要努力把各
层意思看明白。必要时可让学生复述题意。读题时一般不必联系所用的概念、原理。
审题——要指导学生把已知条件、未知条件和要回答的中心问题或关键问题找出来。必要时可在题目上做不同的标记加以明确。
析题——要帮助学生分析题目的知识结构。知识是指化学概念、原理、物质性质、化学用语、化学实验现象等知识技能。结构是指各有关知识和技能因素在题目中的关系。对于难度较大的综合题,在质疑设问的基础上,可引导学生重点研究怎样把复杂问题分解为若干个简单问题,以及简单问题的相互关系,为实施解题奠定基础。
例 1 实验操作如图 28 所示。实验中 A、B 两试管中沉淀分别达到最多时,沉淀的质量是否相等?为什么?
图 28
读题:学生读题,复述题意。找出重要用词“沉淀”、“最多”和“质量”。
审题:找出已知条件。应该找出原来在 A、B 试管中 AlCl3 和 NaOH 物质的量及其关系。在 A 试管中 AlCl3 物质的量等于在 B 试管中 NaOH 物质的量的 1/3,即等于 10-4 摩;找出未知条件。A、B 两支试管中沉淀是什么物质,质量是否相等;找出中心问题与关键问题。沉淀物是何种物质,它与 A、B 两支试管中 AlCl3、NaOH 物质的量有何关系。
析题:首先研究涉及的化学反应。然后,引导学生研究在 A、B 两支试管中沉淀物质的量与起始 AlCl3 或 NaOH 物质的量的关系。这是研究题目中知识的结构。此题的综合程度较大,可以提出若干问题质疑和研讨。
第一组问题:
①A 试管中发生哪些反应?
②实验现象是什么?
③沉淀是何种物质?
④它与 A 试管中 AlCl3 物质的量有什么关系?
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3 物质的量增加。
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 物质的量减少。
NaAlO2 与继续加入的 NaOH 溶液不再反应。
沉淀物是 Al(OH)3。沉淀最多时,在 A 试管中 Al(OH)3 的物质的量等于原 AlCl3 的物质的量,也等于在 B 试管中 NaOH 物质的量的 1/3。
第二组问题:
①B 试管中是否发生 A 试管中的两个反应? TITLE②实验现象与 A 有何不同?
③沉淀是怎样产生的?
④沉淀是何种物质?
⑤它与 B 试管中 NaOH 物质的量是什么关系?
发生与 A 试管中相同的两个反应。析出的沉淀随即与 NaOH 溶液反应
生成 NaAlO2。向 NaAlO2 溶液中继续滴加 AlCl3 溶液时,发生完全水解而析出 Al(OH)3 沉淀。
AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
从各步化学方程式可以看出,在 B 试管中 Al(OH)3 的物质的量等于NaAlO2 的物质的量的 3/4,也等于 B 试管中 NaOH 的物质的量的 1/3。
因此,A、B 两支试管中 Al(OH)3 沉淀的物质的量相等。又因沉淀均为 Al(OH)3,所以沉淀的质量也相等。
(三)指导学生实施解题
指导实施解题,是在读题、审题、析题的基础上,帮助学生找出解题的关键和突破口,选择解题的思路与方法,规范地表达解题的全过程。
例如,解答上题的关键和突破口是确定依次发生的各步化学反应, 确定沉淀是何种物质。解题的思路和方法是综合每个试管中的各步反应中有关物质的量,分别找出 Al(OH)3 物质的量与 B 试管中 NaOH 的物质的量或 A 试管中 AlCl3 的物质的量的关系。解题过程应规范表达,不再赘述。
三、化学习题解法示例
(一)化学选择题常用的解题方法1.直接法
此法常用于解答计算型和实验操作排序型的选择题。解这类题的基本方法是先做后选。在审清题意的前提下,运用关系量、公式和数据进行推导,计算得出结果,或者根据实验目的及操作要求排出正确顺序, 直接找出正确答案。
例 2 为证明氯乙烷含氯元素但不含氯离子,供选择的操作及现象包括:a.取适量氯乙烷样品;b.加热;c.加 NaOH 溶液;d.加 AgNO3 溶液; e. 加过量稀 HNO3;f.有白色沉淀;g.无白色沉淀。正确的操作顺序观察的现象是( )
-
a—c—b—d—e—f
-
a—d—e—g
-
a—d—e—g—a—c—b—e—d—f
-
a—d—e—g—c—b—e—d—f
此题若将各备选答案与题干的背景及要求一一对照,阅读量太大。题中的实验有两项基本要求:证明氯乙烷不含 Cl-;经化学变化产生 Cl- 并加以检验,以证明氯乙烷含氯元素。可以根据这两项要求排出操作步骤及观察实验现象的正确顺序,然后与备选答案比较,直接找出正确答案。
证明氯乙烷不含 Cl-的操作步骤及现象是 a—d—e—g。
水解产生 Cl-并检验 Cl-的操作步骤及现象是 a—c—b—e—d—f。
因此,答案为(C)。2.淘汰法
这是选择题最常用的一种解题方法。广泛应用于解答最佳选择题和多解选择题。其基本方法是从问题的反面入手,只要找出一个例子或一条理由跟备选答案明显不符合,即可将其淘汰。通过对这类答案的否定, 便能获得符合题意的正确答案。
例 3 右图表示温度、压强变化对于下列反应的影响:
 L(固)+G(气)
2R(气)-热量
L(固)+G(气)
2R(气)-热量
图 29 中 y 轴可代表的含义是( )
-
平衡混合气中 R%
-
平衡混合气中 G%
(C)G 的转化率
(D)R 的转化率
图 29
本题的图示可概括为:升高温度 y 值减小;增大压强 y 值增大。这是判断备选答案是否正确的依据。
用淘汰法解此题,是将各备选答案与以上两条判断依据分别对照, 凡有不符,即予淘汰。
在上述可逆反应中,正反应是气体体积增大的吸热反应。增大压强,R%减小,(A)应淘汰。
增大压强,G%增大;升高温度,G%减小,(B)完全符合题意。G%的转化率高低决定 R%的大小。(A)不正确则(C)也不正确。R%的转化率高低决定 G%的大小。(B)正确则(D)也正确。
因此,答案为(B)和(D)。
若解答题干中提供了两重或两重以上前提条件的选择题。可依次将每一重条件与备选答案对照,将不符者逐级筛选去掉,以获得正确答案。
3.分析推理法
此法常用于解答背景材料较丰富,涉及的概念、原理或元素化合物知识较多,综合性较强的选择题。其基本方法是从已知条件出发,正确运用有关概念、原理或规律等,对题目涉及到的内容做全面而周密的分析、推理。在研究众多因素时,往往需要找准解决问题的突破口,再扩大战果,带动整个问题的解决。
例 4 有 A、B、C 三种微粒,其核电荷数依次增大。A 的最外层电子数为 2n2 个;B 有两层电子,次外层有 2 个电子。C 和 B 电子层数相同。A 的核外电子数等于其核内质子数,B 的核外电子数比其核内质子数多一个。C 和 B 结合成离子化合物时,其个数比为 1∶2。则 A、B、C 正确顺序 是 ( )
(A)H、Cl、Mg2+ (B)He、F-、Mg2+
- He、F-、Na+ (D)Ne、Cl-、Ca2+
①分析题意,确定解答问题的突破口。将涉及 A 的条件、B 的条件和
C 的条件分别归结起来,并加以分析,找出 A、B、C 中的哪一个能够先解决,以确定出解答本题的突破口。
A 的最外层电子数为 2n2,核外电子数等于质子数。质子序数 A<B
<C。因此,A 的电子层数只能是 1 或 2,最外层电子数是 2 或 8。又因为A 是中性原子,它可能是氦原子,也可能是氖原子。A 不是突破口。
B 的次外层有 2 个电子,核外电子比其核内质子多 1 个。原子序数 B
>A。因此,该微粒只有两个电子层,且为带一个负电荷的离子。B 只能为 F-。B 是解答此题的突破口。
若 B 仍不能准确判定,则再分析归纳 C 的条件,从 C 突破。
②运用推理,实现问题的解决。
原子序数 A<B,A 的原子序数必小于 9,A 必为 He。C 的原子序数大于 B,C 与 B 电子层数相同。C 与 B 结合成离子化合物时个数比为 1∶2。C 应为带两个正电荷的、有两个电子层的阳离子,C 为 Mg2+。
因此,正确答案为(B)。
(二)化学综合题的解题思路与方法
大型化学综合题对帮助学生理解和运用化学基础知识与基本支能, 对培养学生思维能力和表达能力等,具有特别重要的作用。提高解答综合题的能力,是教师习题教学基本功训练的重要内容之一。现以实验设计型综合题为例,研究综合题的信息接受与信息加工的一般过程与方法。
化学实验设计题,重在培养学生把已有的知识和实验技能运用于新情境的能力,它所选择的课题大多是学生没有直接实践过的。完成这样的任务,不仅要求学生较扎实地掌握实验知识和较熟练地掌握实验技能技巧,还要能从题目中敏捷地接受信息,分析和评价信息,以及选择、调用自己贮存的知识,将新信息与已有知识有机地结合起来,并对旧有知识进行加工和强化,以解答实验设计的新问题。解答这类问题的大致过程与思路如下:
- 接受、分析、筛选信息,明确实验设计的课题、条件和要求
学生阅读习题,要较迅速完全地吸收题目中的新信息,分析提供这些信息的目的并把信息归类,还要对各个信息在实现实验设计中的有效性、重要性做初步的判断,以明确实验课题、实验条件和设计要求。
- 通过对新旧信息的加工,实现指定的实验设计
学生要在把握实验课题、条件和设计要求的基础上,广泛联系旧知识,筛选并提取有关的旧知识,经过思维活动把它们与新信息进行比较、归纳、组织等信息加工,以选定实验方法,完成实验装置与实验操作的设计。
例 5 有 2 瓶 pH=2 的酸溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊试液、酚酞试液、pH 试纸和蒸馏水,而没有其它试剂。简述如何用最简单的实验方法来判别哪瓶是强酸。
[简析]实验课题:判别 pH=2 的酸溶液中的强酸和弱酸。实验条件: 题目限定 4 种备选用的试剂、试纸。石蕊试液和酚酞试液通常只能定性
地区别溶液呈酸性或碱性,它们可能是题设的干扰条件。具体要求:设计实验方法和步骤(简明回答)。基本思路:本题主要涉及强电解质、弱电解质的知识和 pH 值的概念。要把这些旧知识和本实验课题的对象、条件与要求有机结合,经过几步判断组成的推理来选定实验方法。具体过程如下:
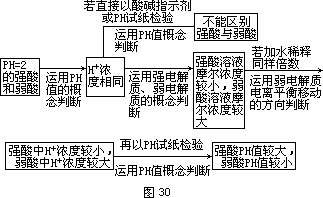
因此,解决本实验课题的方法是将这两种溶液稀释相同倍数,再测定和比较它们的 pH 值。实验操作步骤的设计,要保证稀释的倍数相同。由于 pH 试纸只能粗略地测量 pH 值的近似值,溶液稀释的倍数不能太少。
[答案]各取等体积酸液用蒸馏水稀释相同倍数(100 倍),然后用pH 试纸分别测其 pH 值,pH 值变化大的那瓶为强酸。
例 6 将氯气用导管通入较浓的 NaOH 和 H2O2 的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被 H2O2 还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。
进行此实验,所用的仪器及导管如图 31: 根据要求填写下列空白:
- 组装氯气发生器时,应选用的仪器及导管(填写图中编号)是
。
-
实验进行中,按气流方向从左到右顺序;气体流经的各仪器及导管的编号依次是
。
-
仪器①的橡皮塞上应有 个孔。
图 31
-
实验时,仪器①中除观察到红光外,还有 现象。
-
实验需用约 10%H2O2 溶液 100ml,现用市售
30%(密度近似为1g/cm3)H2O2 来配制,其具体配制方法是 。
-
实验时仪器①中 ClO-与 H2O2 反应的离子方程式是 。
[简析]实验课题:实现 Cl2 与较浓 NaOH 和 H2O2 混合液的反应。实验条件:题目限定使用编号①~⑥的仪器和导管,且④、⑤只限用 1 次。具体要求:设计实验装置——确定组装 Cl2 发生器的仪器和吸收 Cl2 装置的橡皮塞上打孔的数目,以及整套仪器的连接顺序。基本思路:先要区别实验设计问题与其它问题。本大题中的(4)题考查根据化学反应叙述
实验现象,第(5)题考查百分比浓度溶液稀释的计算和基本操作,第(6) 题写出离子方程式,不属于实验设计问题。
从题目提供的实验事实和给定的条件判断,本套装置实质是制 Cl2 装置跟用溶液吸收 Cl2 装置的组合。实验室制 Cl2 和吸收 Cl2 都是已掌握的旧知识,关键是结合给定的条件选择、改造和应用。由于吸收 Cl2 时玻璃管要插到液面下,要求玻璃管的一端要长,必须用④。④、⑤两管各只有 1 个,制 Cl2 装置只能用⑤作气体导管。由于 Cl2 跟较浓 NaOH 和 H2O2 混合液反应产生气体,且吸收 Cl2 很难保证完全,一定有大量气体逸出, 设计装置①时必须留有气体出口。
[答案](1)③、②、⑤;(2)②⑤⑥④①或②⑤⑥④;(3)2, 使瓶内外压强相等;(4)冒气泡;(5)用量筒量取 33(或 34)ml30% H2O2 溶液加入烧杯中,再加入 67(或 66)ml 水(或加水稀释至 100ml), 搅拌均匀;(6)ClO-+H2O2=Cl-+O2↑+H2O。
