1998 年全国高校招生化学统考试题
时量:120 分钟分值:100 分
可能用到的原子量:
H1; C12; N14; O16; Na23; Mg24;
Al27; S32; Cl35.5; K39; Fe56; Zn65
一、选择题(本题包括 5 小题,每小题 3 分,共 15 分。每小题只有一个选项符合题意。)
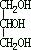 1、1998
年山西朔州发生假酒案,假酒中严重超标的有毒成份主要是
1、1998
年山西朔州发生假酒案,假酒中严重超标的有毒成份主要是
(A) (B)CH3OH
(C)CH3COOCH2CH3 (D)CH3COOH
2、向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是
(A)Na2SiO3 (B)BaCl2 (C)FeCl3 (D)NaAlO2
3、按下述实验方法制备气体,合理而又实用的是
-
锌粒与稀硝酸反应制备H2
-
向饱和氯化钠溶液中滴加浓硫酸制备HCl
-
亚硫酸钠与浓硫酸反应制备SO2
-
大理石与浓硫酸反应制备CO2 4、起固定氮作用的化学反应是
(A)N2 与H2 在一定条件下反应生成NH3
(B)NO 与O2 反应生成NO2
(C)NH3 经催化氧化生成NO
(D)由NH3 制碳酸氢铵和硫酸铵
5、300mL 某浓度的NaOH 溶液中含有 60g 溶质。现欲配制 1mol L -1NaOH 溶液,应取原溶液与蒸馏水的体积比约为
(A)1:4 (B)1:5 (C)2:1 (D)2:3
二、选择题(本题包括 12 小题,每小题 3 分,36 分。每小题有一个或
两个选项符合题意。若正确答案只包括一个选项,多选时,该题为 0 分;
若正确答案包括两个选项,只选一个且正确的给 1 分,选两个且都正确
的给 3 分,但只要选错一个,该小题就为 0 分)
6、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
(A)HI 和HClO (B)HCl 和HIO
(C)HClO3 和HIO (D)HClO 和HIO
7、X 和Y 属短周期元素,X 原子的最层电子数是次外层电子数的一半, Y 位于X 的前一周期,且最外层只有一个电子,则X 和Y 形成的化合物的化学式可表示为
(A)XY (B)XY2 (C)XY3 (D)X2Y3
8、反应 4NH3(气)=4NO(气)+6H2O(气)在 2L 的密闭容器中进行,1 分钟后,NH3 减少了 0.12mol,则平均每秒钟浓度变化正确的是
(A)NO:0.001molL-1 (B)H2O:0.002molL-1
(C)NH3:0.002molL-1 (D)O2:0.00125molL-1
9、用水稀释 0.1mol L-1 氨水时,溶液中随着水量的增加而减小的是
(A)[OH-]/[NH3H2O] (B)[NH3H2O]/[OH-]
(C)[H+]和[OH-]的乘积 (D)OH-的物质的量10、下列关于铜电极的叙述正确的是
-
铜锌原电池中铜是正极
-
用电解法精炼铜时粗铜作阴极
-
在镀件上电镀铜时可用金属铜作阳极
-
电解稀硫酸制H2、O2 时铜作阳极
11、等体积浓度的MOH 强碱溶液和 HA 弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是
(A)[M+]>[OH-]>[A-]>[H+] (B)[M+]>[A-]>[H+]>[OH-]
(C)[M+]>[A-]>[OH-]>[H+] (D)[M+]+[H+]=[A-]+[OH-]
12、下列分子中所有原子都满足最外层 8 电子结构的是
(A)光气(COCl2) (B)六氟化硫
(C)二氟化硫 (D)三氟化硼13、下列叙述正确的是
-
同主族金属的原子半径越大熔点越高
-
稀有气体原子序数越大沸点越高
-
分子间作用力越弱分子晶体的熔点越低
-
同周期元素的原子半径越小越易失去电子
14、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
(A)硫酸 (B)氯水 (C)硝酸锌 (D)氯化铜
15、有五瓶溶液分别是:①10mL0.60mol L -1NaOH 溶液,②20mL0.50mol L-1H2SO4 水溶液,③ 30mL0.40mol L -1HCl 水溶液,④ 40mL0.30mol L -1HAc 水溶液,⑤50mL0.20mol L-1 蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
(A)①>②>③>④>⑤ (B)②>①>③>④>⑤
(C)②>③>④>①>⑤ (D)⑤>④>③>②>① 16、依照阿伏加德罗定律,下列叙述中正确的是
-
同温同压下两种气体的体积之比等于摩尔质量之比
-
同温同压下两种气体的物质的量之比等于密度之比
-
同温同压下两种气体的摩尔质量之比等于密度之比
-
同温同体积下两种气体的物质的量之比等于压强之比17、下列反应的离子方程式正确的是
-
次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2==CaCO3↓+2HClO
-
硫酸亚铁溶液中加过氧化氢溶液Fe2++2H2O2+4H+==Fe3++4H2O
-
用氨水吸收少量二氧化硫NH3H2O+SO2==NH4++HSO3-
-
硝酸铁溶液中加过量氨水Fe3++3NH3H2O==Fe(OH)3↓+3NH4+
三、选择题(本题包括 8 小题,每小题 4 分,共 32 分。每小题只有一个选项符合题意。)
18、pH=13 的强碱溶液 pH=2 的强酸溶液混合,所得混合液的 pH=11, 则强碱与强酸的体积比是
(A)11:1 (B)9:1 (C)1:11 (D)1:9
19、体积相同的甲、乙两个容器中,分别都充有等物质的量的 SO2 和O2 在相同温度下发生反应:2SO2+O2=2SO3,并达到平衡。在这过程中, 甲容器保持体积不变,乙容器保持压强不变,若甲容器中 SO2 的转化率
为p%,则乙容器中SO2 的转化率
(A)等于p% (B)大于p%
(C)小于p% (D)无法判断
20、由锌、铁、铝、镁四种金属中的两种组成的混合物 10g,与足量的盐酸反应产生的氢气在标准状况下为 22.2L,则混合物中一定含有的金属是
(A)锌 (B)铁 (C)铝 (D)镁
21、将标准状况下的aLHCl(气)溶于 1000g 水中,得到盐酸密度为bgcm-3,则该盐酸的物质的量深度是
(A)a/22.4molL-1 (B)ab/22400molL-1
( C ) ab/(22400+36.5a)molL-1 ( D ) 1000ab/(22400+36.5a)molL-1
22、将质量分数为 0.052(5.2%)的NaOH 溶液 1L(密度为 1.06g cm-
3)用铂电极电解,当溶液中 NaOH 的质量分数改变了 0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
|
NaOH 的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
|---|---|---|---|
| ( A ) |
0.062(6.2%) |
19 |
152 |
| ( B ) |
0.062(6.2%) |
152 |
19 |
| ( C ) |
0.042(4.2%) |
1.2 |
9.4 |
| ( D ) |
0.042(4.2%) |
9.4 |
1.2 |
23、在一定体积的密闭容器中放入 3L 气体R 和 5L 气体 Q,在一定条件下发生反应 2R(气)+5Q(气)==4X(气)+nY(气)反应完全后, 容器温度不变,混合气体的压强是原来的 87.5%,则化学方程式中的 n 值是
(A)2 (B)3 (C)4 (D)5
24、1,2,3-三苯基环丙烷的 3 个苯基可以分布在环丙烷环平面的
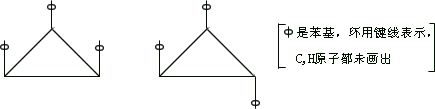 上下,因此有如下
2 个异构体。
上下,因此有如下
2 个异构体。
据此,可判断 1,2,3,4,5-五氯环戊烷(假定五个碳原子也处
于同一平面上)的异绝体数是
(A)4 (B)5 (C)6 (D)7 25、白藜芦醇
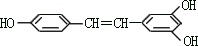
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟 1mol 该化合物起反应的Br2 或H2 的最大用量分别是
(A)1mol,1mol (B)3.5mol,7mol
(C)3.5mol,6mol (D)6mol,7mol 四、(本题包括 2 小题,共 17 分)
26、(6 分)A~D 是中学化学实验中常见的几种湿度计装置示意图。
- 请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C 下的空格中(多选要倒扣分)
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
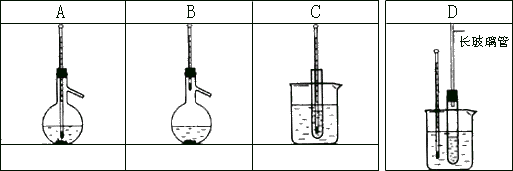 ⑧食盐和浓硫酸混合加热制氯化氢
⑧食盐和浓硫酸混合加热制氯化氢
- 选用装置D 做苯的硝化实验,D 中长玻璃管的作用是:
27、(11 分)测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL 烧杯、100mL 量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度 1.19g cm-3)、水。按图示装置进行实验, 回答下列问题。(设合金样品全部反应,产生的气体不超过 100mL)
-
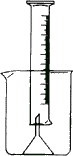 补充下列实验步骤,直到反应开始进行(铁架台的铁夹的安装可省略):
补充下列实验步骤,直到反应开始进行(铁架台的铁夹的安装可省略): -
合金样品用铜网包裹的目的是:
五、(本题包括 3 小题,共 17 分) 28、(42 分)高锰酸钾和氢溴酸溶
液可以发生下列反应:
KMnO4+HBr→Br2+MnBr2+KB4+H2O
其中还原剂是 。若消耗0.1mol 氧化剂,则被氧化的还原剂的物质的量是 mol。
29、(6 分)下图中①~⑾分别代表有关反应中的一种物质,请填写以下空白。
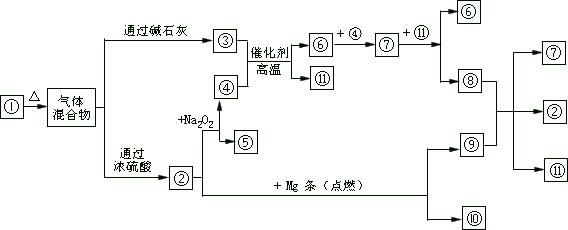
-
①、③、④的化学式分别是 、 、 。
-
⑧与⑨反应的化学方程式是 。
30、(7 分)BGO 是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在 BGO 中,锗处于其最高价态,②在 BGO 中,铋的价态与铋跟氯形成的某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层 8 电子稳定结构,③ BGO 可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO 晶体的化学式中,这两种氯化物所含氧的总质量相同。请填空:
-
锗和铋的元素符号分别是 和 。
-
BGO 晶体的化学式是 。
-
BGO 晶体中所含铋氧化物的化学式是 。六、(本题包括 3 小题,共 18 分)
31、(6 分)某高校曾以下列路线合成药物心舒宁(又名冠心宁), 这是一种有机酸盐。
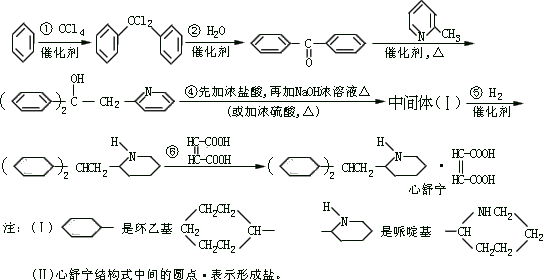
-
心舒宁的分子式为 。
-
中间体(I)的结构简式是 。
-
反应①~⑤中属于加成反应的是 (填反应代号)。
-
如果将⑤、⑥两步颠倒,则最后得到的是:(写结构简式) 32、(6
分)请认真阅读下列 3 个反应:
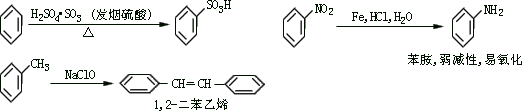
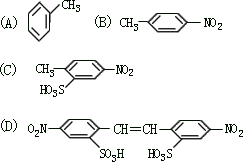
利用这些反应,按以下步骤可从某烃 A 合成一种染料中间体 DSD
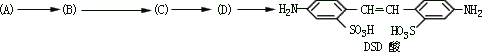 酸。
酸。
请写出(A)、(B)、(C)、(D)的结构简式。
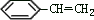 33、(6
分)某种 ABS 工程树脂,由丙烯腈(CH2=CHCN,符号 A)、
33、(6
分)某种 ABS 工程树脂,由丙烯腈(CH2=CHCN,符号 A)、
1,3-丁二烯(CH2=CHCH=CH2,符号 B)和苯乙烯( , 符号S)按一定配比共聚而得。
-
A、B 和S 三种单体,碳氢比(C:H)值最小的单位体是 。
-
经元素分析可知该ABS 样品的组成为CaHbNc(a、b、c
为正整数),则原料中A 和B 的物质的量之比是 (用a、b、c 表示)。七、(本题包括 2 小题,共 15 分)
34、(7 分)本题分子量用以下数据:H2O 18.0 CaO 56.0 CaO2
72.0
过氧化钙是一种完全无毒的氧化物,通常含有部分 CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
①称取 0.270g 样品,灼热使之完全分解,生成 CaO、O2 和 H2O 得
到的O2 在标准状况下体积为 33.6mL。
②另取 0.120g 样品,溶于稀盐酸,加热煮沸,使生成的 H2O2 完全分解。然后将溶液中的 Ca2+完全转化为 CaC2O4 沉淀,经过滤洗涤后, 将沉淀溶于热的稀硫酸,用 0.0200mol L-1KMnO4 溶液滴定,共用去31.0mL KMnO4 溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4==K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
-
写出CaO2 受热分解的化学方程式。
-
计算样品中CaO2 的质量分数。
-
计算样品中CaO2 xH2O 的x 值。
35、(8 分)下面的四种盐在不同温度下的溶解度(g/100gH2O)
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
|---|---|---|---|---|
|
10 ℃ |
80.5 |
20.9 |
35.7 |
31.0 |
|
100 ℃ |
175 |
246 |
39.1 |
56.6 |
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计。)
- 取 23.4gNaCl 和 40.4gKNO3,加 70.0gH2O,加热溶解。在 100
℃时蒸发掉 50.0gH2O,维持该温度,过滤析出晶体,计算所得晶体的质量(m 高温)。
- 另取 34.0gNaNO3 和 29.8gKCl,同样进行如上实验。10℃时
析出的晶体是 (写化式)。100℃和 10℃得到的晶体质量(m'高温和m'低温)分别是多少?
1998 年全国高校招生化学统考试题答案
一、
1B 2D 3C 4A 5A
二、
|
6B |
7A |
8AD |
9B 10AC |
|---|---|---|---|
|
11CD |
12A |
13BC |
14BC 15D |
|
16CD 三、 |
17D |
||
|
18D 19B |
20C |
21D |
|
|
22B 23A |
24A |
25D |
四、
26、(1) A:① B:③⑤ C:⑦
(2) 减少苯的挥发(或答起冷凝器的作用)
27、(1)①将称量后的合金样品用铜网小心包裹好,放在
800mL烧杯底部,把短颈漏斗倒扣在样品上面。②往烧杯中注入水,直至水面没过漏斗颈。③在100mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈伸入量筒中。烧杯中水面到杯口至少保留约100mL空间。④将长颈漏斗
(或答玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓
盐酸,至有气体产生。
- 使样品在反应时能保持在烧杯适当的位置(或答避免反应时样品漂浮)
五、
28、HBr; 0.5
29、(1)NH4HCO3; NH3; O2
(2)C+4HNO3=2H2O+4NO2↑+CO2↑
30、(1)Ge; Bi
-
Bi4Ge3O12〔或2Bi2O3·3GeO2、Bi4(GeO4)3〕
-
Bi2O3
六、
31、(1)C23H39NO4
(2)
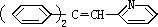
(3)③、⑤
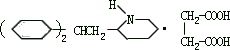 32、
32、
33、(1)1,3-丁二烯(写B或写结构简式也可)
(2)c:(b-a/2)〔或2c:(b-a)〕
七、
34、(1)2CaO2=2CaO+O2
(2)w(CaO2)=(33.6×10-3L/22.4·mol-1)×2× 72.0g·mol-1/0.272g×100%=80%
(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol·L- 1×5/2=0.00155mol
其中CaO2所含的n(Ca2+)=0.120g×80.0%/72.0g·mol-1
=0.00133mol/m(CaO)
=(0.00155mol-0.00133mol)×
- g·mol-1
0.012g
=0.012gm(H2O)
=0.120g-0.120g×80.0%-
=0.012g (0.120g×80.0%/72.0g·mol-1)
:(0.012g/18.0g·mol-1)
=2:1
x=1/2
35、(1)100℃蒸发掉50.0gH2O后溶液中NaCl的质量为
39.1g×(70.0g-50.0g)/100g=7.82g
析出的NaCl晶体质量m高温=23.4g-7.82g=15.6g 将滤液冷却至10℃,待充分结晶后,过滤。
计算所得晶体的质量(m低温)。
冷却到10℃,析出的NaCl晶体质量为
(39.1g-35.7g)×(70.0g-50.0g)/100g=0.68g
溶液中KNO3的质量为20.9g×(70.7g-50.0g)/100g
=4.18g
析出的KNO3晶体质量为40.4g-4.18g=36.2g 10℃析出的晶体总质量m低温=0.68g+36.2g=36.9g
(2)m'高温=m高温=15.6g m'低温=m低温=36.9g
