1999 年普通高等学校招生全国统一考试化学试卷(全文)
本试卷分第 I 卷(选择题〕和第 II 卷(非选择题)两部分,第 I 卷 1 至 4 页,第II 卷 5 至 10 页。共 150 分。考试时间[120]分钟。
第I 卷(选择题共:83 分)
试题答案 注意事项:
-
答第I 卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
-
每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑如需改动佣橡皮擦干净后。再选涂其它答案,不能答在试题卷上。
-
考试结束,监考人将本试卷和答题卡一并收回。
可能用到的原子量:Hl C12 N14 Ol6 Na23 Mg 24
一.选择题(本题包括 5 小题,每小题 3 分,并 15 分,每小题只有一个选项符合题意。)
- 近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是A.提高汽油燃烧效率 B.降低汽油成本
C.避免铅污染大气 D.铅资源短缺
- Murad 等三位教授最早提出 NO
分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了 1998 年诺贝尔医学及生理学奖,关于NO 的下列叙述不正确的是
A.NO 可以是某些含低价N 物质氧化的产物B.NO 不是亚硝酸酐
C.NO 可以是某些含高价N 物质还原的产物D.NO 是红棕色气体
- 原计划实现全球卫星通讯需发射 77
颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相等,因此称为“铱星计划”。已知铱的一种同位素是 19177Ir,则其核内的中子数是
A.77 B.114 C.191 D.268
- 已知自然界中铱有两种质量数分别为 191 和 193
的同位素,而铱的平均原子量为 192.22,这两种同位素的原子个数比应为
A.39∶61 B.61∶39 C.1∶1 D.39∶11
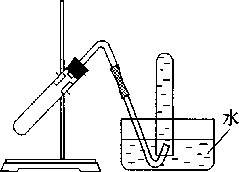 右图装置可用于A.加热NaHCO3
右图装置可用于A.加热NaHCO3
制CO2
-
用Cu 与稀HNO3 反应制NO
-
用 NH4Cl 与浓 NaOH 溶液反应制NH3
-
用NaCl 与浓H2SO4 反应制HCl
二.选择题(本题包括 12 小题,每小题 3 分,共 36 分。每小题有一个
或两个选顶符合题意。若正确答案只包括一个选项,多选时,该题为 0
分:着正确答案包括两个选项,只选一个且正确的给 1 分,选两个且都
正确的给 3 分,但只要选错一个,该小题就为 0 分。) 6.关于晶体的下列说法正确的是
- 在晶体中只要有阴离子就一定有阳离子B.在晶体中贝要有阳离子就一定有阴离子C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
-
下列各分子中所有原子都满足最外层为 8 电子结构的是A.BeCl2 B.PCl3 C.PCl5 D.N2
-
下列说法正确的是(N 表示阿伏加德罗常数的值〕A.28g 氮气所含有的原子数目为N
-
4g 金属钙变成钙离子时失去的电子数目为O.1N
-
lmol 甲烷的质量与N 个甲烷分子的质量之和相等
-
标准状况下,22.4L 甲烷和乙炔混合物所含的分子数为N
9.下列反应的自子方程式正而的是
-
碳酸氢钙溶液跟稀硝酸反应HCO3-+H+=H2O+CO2
-
饱和石灰水跟稀硝酸反应Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸NH3.H2O+H+=NH4++H2O
D.碳酸钙溶于醋酸中CaCO3+2H+=Ca2++H2O+CO2
 10.反应
4NH3(气)+5O3(气) 4NO(气)+6H3O(气)在 10L
密闭容器中进行,半分钟后,水蒸气的物质的量增加了 0.45mol,则此反
10.反应
4NH3(气)+5O3(气) 4NO(气)+6H3O(气)在 10L
密闭容器中进行,半分钟后,水蒸气的物质的量增加了 0.45mol,则此反
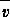 应的平均速率
(X)(反应物的消耗速率或产物的生成速率)可表示为A.
(NH3)=0.0101mol.L-1.s-1
应的平均速率
(X)(反应物的消耗速率或产物的生成速率)可表示为A.
(NH3)=0.0101mol.L-1.s-1
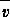 B.
(O2)=0.0010mol.L-1.S-1
B.
(O2)=0.0010mol.L-1.S-1
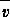 C.
(NO)=0.0010mol.L-1.s-1
C.
(NO)=0.0010mol.L-1.s-1
D. (H2O)=0.045mol.L-1.s-1
- 关于IA 族和IIA 族元素的下列说法中正确的是A.在同一周期中,IA 族单质的熔点比IIA 族的高
-
浓度都是 0.01mol.L-1 时,氢氧化钾溶液的 pH 比氢氧化钡的小
-
氧化钠的熔点比氧化镁的高
-
 加热时,碳酸钠比碳酸镁易分解
加热时,碳酸钠比碳酸镁易分解
- 化合物的 中的 OH
被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是
A.HCOF B.CCl4 C.COCl2 D.CH2ClCOOH
13 x 、y、z 为短周期元素,这些元素原子的最外层电子数分别是 1、4、
- 则由这三种元素组成的化合物的化学式不可能是A.XYZ B.X2YZ C.X2YZ2 D.X2YZ3
l4.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
 (1/2)H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述中正确的是
(1/2)H2+NiO(OH)
Ni(OH)2。根据此反应式判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的OH 不断增大B.电池放电时,镍元素被氧化
C.电池充电时。氢元素被还原D.电池放电时,H2 是负极
-
下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是
- Na+ Ba2+ Cl- SO42+
B.K+ AlO2- NO3- OH- C.H+ NH4+ Al3+ SO42+ D.H+ Cl- CH3COO- NO3-
-
下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应。就可以将它们区别开的是
-
硝酸钾 硫酸钠氯化钙氯化钡
-
硫酸 硫酸铝 氯化钠 氢氧化钠
-
盐酸 硫酸钠碳酸钠氢氧化钠
-
硫酸氢钠 硫酸镁 碳酸钠 氦氧化钠
-
-
 下列有机分子中,所有的原子不可能处于同一平面的是
下列有机分子中,所有的原子不可能处于同一平面的是
三.选择题(本题包括 8 小题,每小题 4 分,共 32 分。每小题只有一个选项符合题意。)
- 用 0.1mol.L-1 NaOH 溶液滴定O.lmol.L-1 盐酸,如达到滴定的终
点时不慎多加了 1 滴 NaOH 溶液(1 滴溶液的体积约为 0.05mL〕.继续加水至 50mL,所得溶液的pH 是
A.4 B.7.2 C.10 D.11.3
- X、Y、Z 为三种气体。把 a molX 和 b molY 充入一密闭容器中。发生反应X+2Y 2Z 达到平衡时,若它们的物质的量满足:n(X)
+n(Y)=n(Z),则Y 的转化率为
A.[(a+b)/5]×100% B.[2(a+b)/5b]×100% C.[2(a+b)/5 ]×100% D.[(a+b)/5a]×100%
- 已知 25%氨水的密度为 0.91g.cm-3,5%氨水的密度为 0.98g·cm-
3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
- 等于 15% B.大于 15% C.小于 15% D.无法估算
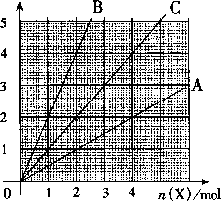 右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量
右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量
n(X).纵坐标表示消耗O2 的物质的量n(O2),A、B 是两种可燃气体,C 是A 和B 的混合气化则C 中n(A):n(B) 为
A.2:1 B.1:2
C.1:1 D.任意比
- 制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为
2FeCl3+Cu=2FeCl2+CuCl2 向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
- 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D.烧杯中铁、铜都无
- 一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3—— HNO3+N2+N2O,在反应中被氧化与被还原的氮原子数之比为
A.5:3 B.5:4 C.1:1 D.3:5
- 用惰性电极电解 M(NO3)x 的水溶液,当阴汲上增重 ag 时,在阳极上同时产生bL 氧气(标准状况〕:从而可知M 的原子量为
A.22.4ax/b B11.2ax/b C.5.6ax/b D.2.5ax/b
- A、B、C、D 都是含碳、氢、氧的单官能团化合物,A 水解得B 和C, B 氧化可以得到C 或D,D 氧化也得到C。若 M(X)表示X 的摩尔质量, 则下式中正确的显
A.M(A)=M(B)+M(C) B.2M(D〕= M(B)+M(C) C.M(B)< M( D)<M(C) D.M(D〕<M(B)<M(C)
第II 卷(非选择题共 67 分〕
注意事项:
-
第II 卷共 6 页,用钢笔或圆珠笔直接答在试题卷上。
-
答卷前将密封线内的项目填写清楚。四.(本题包括 2 小题,共 18 分)
 26(4
分)填空
26(4
分)填空
-
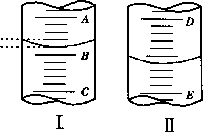
图 1 表示 10mL 量筒中液面的位置A 与B,B 与C 刻度间相差 1mL, 如果刻度A 为 4,量简中液体的体积是 mL。
-
图 II 表示 50mL 滴定管中液画的位置,如果液面处的读数是 a ,则滴定管中液体的体积(填代号)
A. 是 amL B. 是 (50-a)mL
C. 一定大于 amL D.一定大于
(50-a)mL
27. (14 分)为了测定人体新陈代谢呼出气体中 CO2 的体积分数,某
学生课外小组设计了如下图的实验装置。实验中用过量 NaOH 溶液吸收气体中的 CO2,准确测量瓶 I 中溶液吸收 CO2 后的增重及剩余气体的体
积(实验时只用嘴吸气和呼气),请填空。
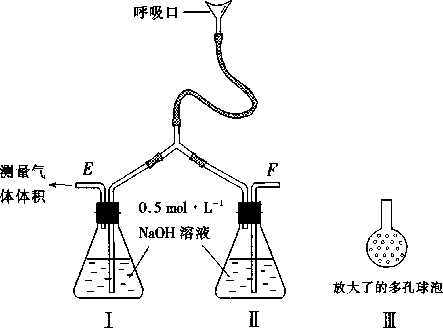
(1)图中瓶II 的作用是 。
- 对实验装置尚有如下A、B、C、D 四种建议,你认为合理的是
。(填代号〕
-
在E 处增加CaCl2 干燥管
-
在下处增加CaCl2 燥管
-
在E 和F 两处增加CaCl2 干燥管D.不必增加干燥管
(3〕将插入溶液的管子丁端改成具有多孔的球泡(图中的皿), 有利于提高实验的准确度,其理由是 。
(4〕实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据: 瓶 I 溶液增重 ag,收集到的气体体积(标准状况)为 bL,该呼出气体中CO2 的体积分数是(列出算式) 。
(5 〕实验中若猛吸猛呼,会造成不安全后果,猛吸时会
。猛呼时会 。五.(本题包括 2 小题,共 17 分)
28.(8 分〕提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
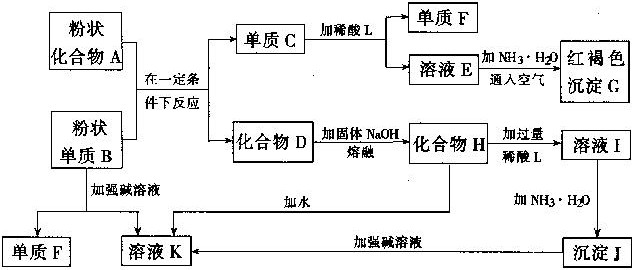
(1)单质F 是 。
(2)写出由 E 生成 G 的离子反应方程式(或化学方程式)
。
(3)溶液I 中所含金属离于是 。
(4)由 CEF 若改用浓酸,则不能选用的浓酸是(写分子式)
。
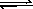
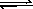 29(9
分)某二元弱酸(简写为 H2A)溶液,按下式发生一级和二级电离:H2A
H++HA-HA- H++A2-已知相同浓度时的电高度 a(H2A)
29(9
分)某二元弱酸(简写为 H2A)溶液,按下式发生一级和二级电离:H2A
H++HA-HA- H++A2-已知相同浓度时的电高度 a(H2A)
>d(HA-),设有下列四种溶液:
A. 0.01mol.L-1 的H2A 溶液B.0.01mol.L-1 的NaH4 溶液
C.0.01mol.L-1 的HCl 与 0.04mol.L-1 的NAHA 溶液等体积混合液D.0.02mol.L-1 的NaOH 与 0.02 mol.L-1 的 NaHA 溶液等体积混合
液
据此,填写下列空白(填代号)
(1)[H+]最大的是 ,最小的是 。(2)[H2A]最大的是 ,最小的是 。(3)[A2-]最大的是 , 最小的是 。
六.(本题包括 2 小题,共 17 分)
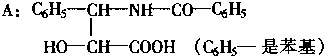 30.(7
分)紫杉醇是一种新型抗癌药,其分子式为 C47H51NO14,它是由如下的A 酸和B
醇生成的一种酯。
30.(7
分)紫杉醇是一种新型抗癌药,其分子式为 C47H51NO14,它是由如下的A 酸和B
醇生成的一种酯。
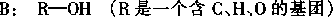
(1 〕 A 可在无机酸催化下水解,其反应方程式是
。
(2)A 水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在
(填希腊字母) 位。(3〕写出ROH 的分子式:
- (10 分)提示:通常,溴代烃既可以水解生成醇,也可以消去
溴化氢生成不饱和烃。如:
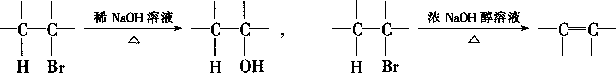
请观察下列化合物 AH 的转换反应的关系图(图中副产物均未写出),并填写空白:
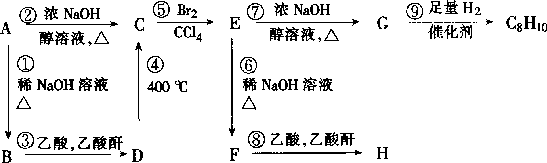
(1 〕 写 出 图 中 化 合 物 C 、 G 、 H 的 结 构 简 式 : C G H 。
(2〕属于取代反应的有 。(填数字代号,错答要倒扣分〕
七.(本题包括 2 小题,共 15 分)
32.(6 分〕取一根镁条置于坩蜗内点燃,得到氧化镁和氮化镁混合物的总质量为 0.47Og 冷却后加入足量水,将反应产物加热蒸于并的烧, 得到的氧化镁质量为 0.486 g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。(2)计算燃烧所得混合物中氮化镁的质量分数。
33(9 分)
- 中学教材上图示了NaCl 晶体结构,它向三维空间延伸得到完美晶体。 NiO(氧化镍〕晶体的结构与 NaQ 相同,Ni2+与最邻近 O2-的核间距离为 a10-8cm,计算 NiO 晶体的密度(已知 NiO 的摩尔质量为74.7g.mol-1).
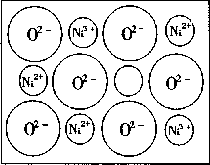 (2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种
NiO 晶体中就存在如右图所示的缺陷:一个
Ni2+空缺另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中
Ni 和 O
的比值却发生了变化。某氧化镍样品组成为Nio970,试计算该晶体中Ni3+与Ni2+的离子数之比。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种
NiO 晶体中就存在如右图所示的缺陷:一个
Ni2+空缺另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中
Ni 和 O
的比值却发生了变化。某氧化镍样品组成为Nio970,试计算该晶体中Ni3+与Ni2+的离子数之比。
1999 年普通高等学校招生全国统一考试化学试题参考答案及评分标准
一、(本题包括 5 小题,每小题 3 分,共 15 分)
1、C 2、D 3、B 4、A 5、B
二、(本题包括 12 小题,每小题 3 分,共 36 分)
三
四、(本题包括 2 小题,共 18 分) 26、(4 分)
(1) 3.2 (2 分〕
(2) D (2 分,若答案中出现其他选项,0 分) 27、(14 分)
(1)除去吸人空气中的CO2 (2 分)
(2) D(2 分)
(3)可增大气体与溶液的接触面积,使气体中的(CO2 被充分吸收(3 分)
(说明;只要答出其中一点,就给 3 分)
(4)[(ag/44g·mol-1)×22.4L·mol-1]/[bL+(ag/44g.mol-1 × 22.4L·mol-1)]
或:(22.4L·mol-1 ×ag)/(bL×44g·mol-1+ag×22.4Lmol-1)× (5.6a/11b+5.6a)×(5.6a/11b+5.6a)×100%(3 分)
(5)把瓶1 中的NaOH 溶液吸人口中;把瓶 II 中的NaOH 溶液吹出瓶外。(各 2 分,共 4 分〕
五、 (本题包括 2 小题,共 17 分) 28、(8 分)
(1)H2
(2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
或 : Fe2++2NH3 · H2O=Fe(OH)2 ↓ +2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
-
Al3+和Na+
-
H2SO4(或HNO3) (每空 2 分,共 8 分〕29、(9 分)
-
A,D (答对 1 空给 1,2 空全对给 3 分)
-
C,D (答对 1 空给 1 分,2 空全对给 3 分)
-
D,A (答对 1 空给 1 分,2 空全对给 3 分〕30、(7 分)
( 1 )
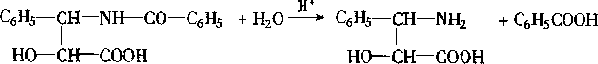
(-NH2 写成-NH3+也对) (2 分)
(2)a(2 分)
(3)C31H38O11 (3 分)
31、(10 分) (3 分)
( 1 )
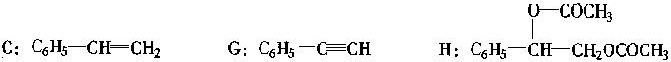
(每个 2 分,共 6 分)
(2)①③⑥⑧ (每个 1 分,共 4 分,错答 l 个倒扣 1 分,本小题不出现负分)
六、(本题包括 2 小题,共 15 分) 32、(6 分)
(1)Mg3N2+6H2O=2NH3↑+3Mg(OH)2(1 分)
(2)解法一:设原混合物中Mg3N2 的质量为x,由 Mg3N2 生成的MgO 的质量为r。
Mg3N2→3MgO
100 120
x y
y=120x/100(2 分)
(0.470g-x)+(120x/100)=0.486g (1 分)
x=0.080g (1 分) 0.080/0.470g=17% (1 分)
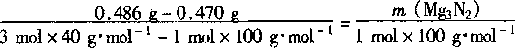 解法二:
解法二:
(3 分)
mMg3N2=0.080g (1 分 ) 0.080g/0.470g=17% (1 分)
(说明,其它列式只要正确都给分。) 33.(9 分)
(1)1cm3 中阴、阳离子总数=(1.00cm/a×10-8cm)3(2 分)
1cm3 中 Ni2+-O2- 离子对数=(1.00cm/a×10-8cm)3 ×1/2 (l
分〕
密度=a×10-8cm3/2×6.02×1023mol-1 (2 分)
(说明:列式不化简不扣分;式中 6.02×1023mol-1 用符号 NA 代
入,即:
密度= [(1.00cm/a × 10-8cm)3 × 74.7g · mol-1]/2 × NA = (62.0/a3)g cm-3,同样给分)
(2)设 1mol Ni0.97O 中含Ni3+x mol, Ni2+(0.97-x)mol
根据电中性:3x mol + 2(0.97-x)mol=2×1mol (2 分)
x=0.06 (1 分〕Ni2+为(0.97-x)mol=0.91
离子数之比 Ni3+:Ni2+=0.06:0.91=6:91 (1 分)
