三、化学基本计算
计算物质的式量 式量就是化学式中各原子的原子量的总和。计算物质式量的步骤是:(1)写出物质正确的化学式;(2)用各元素的原子量分别乘以化学式中所含的该原子个数,得出各元素的原子量之和;(3)把各元素原子的原子量之和相加,就可算出该物质的式量。
[例]计算明矾晶体的式量。
[ 分析] 明矾晶体的化学式是 KAl(SO4)2 · 12H2O ,计算结晶水合物
(A·nH2O)的式量,先要算出 A 的式量,再用水的式量乘以所含结晶水个数n,算出含有的结晶水的式量,把无水盐 A 的式量与结晶水 nH2O 的式量相加, 便可得到结晶水合物(A·nH2O)的式量。在结晶水合物 A·nH2O 的化学式中, A 与 nH2O 之间的小圆点“·”,在计算时是表示相加的符号。
[解]明矾的化学式是 KAl(SO4)2·12H2O,其中无水盐 KAl(SO4)2 的式量为: 39×1+27×1+(32+16×4)×2=258
明矾 KAl(SO4)2·12H2O 中含有结晶水的式量为:
(1×2+16)×12=216
明矾晶体的式量为:
258+216=474
答:明矾晶体的式量是 474。
计算化合物中各元素的质量比 化合物中各元素的质量比,就是在该化合物的一个分子中各元素原子的原子量之和的比值。计算化合物中各元素的质量比,要依据化合物的化学式分别算出各元素的原子量之和,再进而求出各元素的原子量之和的比值。
[例]计算四氧化三铁中铁元素与氧元素的质量比是多少?
[分析]四氧化三铁的化学式是 Fe3O4,在 Fe3O4 的一个分子中,含有 3 个铁原子和 4 个氧原子,3 个铁原子的原子量之和是:
3×56=168
4 个氧原子的原子量之和是:
4×16=64
铁元素与氧元素的质量比是 168:64,可简化为 21:8。[解]在 Fe3O4 中铁元素与氧元素的质量比是:
3×56∶4×16=21∶8
答:在 Fe3O4 中 Fe 与 O 的质量比是 21 比 8。
计算化合物中各元素的百分含量 计算化合物中各元素的百分含量, 先要写出该化合物的化学式并计算出式量,再用化学式中各元素原子的原子量之和,分别除以化合物的式量,乘以百分之百,便可算出化合物中各元素的百分含量。
[例]计算化肥硝酸铵(NH4NO3)中氮元素、氢元素、氧元素的百分含量。[分析]计算化合物中某元素的百分含量可以应用下面的公式:
化合物中某元素的百分含量 = 元素原子量×原子个数 ×100%
化合物式量
在 NH4NO3 中氮元素的百分含量为:
氢元素的百分含量为:
N的原子量×2
NH4 NO3 式量×100%
氧元素的百分含量为:
H的原子量×4 NH4 NO3 式量
×100%
O的原子量×3 ×100%
NH4 NO3式量
[解]氢的原子量是 1,氮的原子量是 14,氧的原子量是 16,NH4NO3 的式量是 80。在 NH4NO3 中氮元素的百分含量是:
14×2 ×100% = 35%
80
氢元素的百分含量是:
氧元素的百分含量是:
1×4 ×100% = 5%
80
16×3 ×100% = 60%
80
答:在 NH4NO3。中含 N35%,含 H5%,含 O60%。
溶解度的计算 在一定温度下的饱和溶液里,溶质的质量、溶剂的质量与该物质的溶解度存在以下关系:
溶质的质量(克) = 溶解度(克)
溶剂的质量(克) 100(克)
将上式移项处理后可得:
溶解度 = 溶质的质量 ×100
溶剂的质量
只要知道饱和溶液里溶质的质量和溶剂的质量,便可以计算出该物质在该温度下的溶解度。
[例]在 20℃时,把 25 克蓝矾(CuSO4·5H2O)溶解在 71 克水中,恰好形成饱和硫酸铜溶液,计算 20℃时 CuSO4 的溶解度。
[分析]蓝矾溶于水中形成硫酸铜饱和溶液,在该饱和溶液中,溶质是CuSO4,溶剂是 H2O。蓝矾是带有 5 个结晶水的硫酸铜,在本题中计算溶质 CuSO4的质量时,要把含水晶体 CuSO4·5H2O 的质量换算为无水 CuSO4 的质量;在计算溶剂的质量时,又要加上 25 克 CuSO4·5H2O 中含有的结晶水的质量。[解]在该饱和硫酸铜溶液中溶质 CuSO4 的质量是:
25克× 160 = 16克
250
溶剂的质量是:
71克 + 25克×
90 = 80 克
250
在 20℃时 CuSO4 的溶解度是:
16克
80克 ×100克 = 20克
答:20℃时 CuSO4 的溶解度是 20 克。
质量百分比浓度的计算 依据质量百分比浓度的定义,计算溶液的质量百分比浓度,可以应用下列换算式:
质量百分比浓度 = 溶质的质量 ×100%
溶液的质量
计算质量百分比浓度还要应用下面的公式:
溶液的质量=溶质的质量+溶剂的质量
当已知溶液的密度 d 和体积 V,计算溶液、溶质的质量,还可以应用下面的公式:
溶液的质量(克)=溶液密度 d(克/厘米 3)×V(厘米 3)
溶质的质量(克)=d(克/厘米 3)×V(厘米 3)×质量百分比浓度关于溶液质量百分比浓度的计算,主要有以下三种基本类型:
①已知溶质和溶剂的质量,计算溶液的质量百分比浓度
[例]把 2 克固体 NaOH 溶解在 18 克水中,计算所得溶液的质量百分比浓度。
[分析]在该 NaOH 溶液中,溶质的质量是 2 克,溶剂的质量是 18 克,溶液的质量是:
2 克+18 克=20 克氢氧化钠溶液的质量百分比浓度为:
NaOH质量
溶液的质量 ×100%
[解]
2克
18克 + 2克 ×100% = 10%
答:该 NaOH 溶液质量百分比浓度是 10%。
②已知溶液的质量百分比浓度,计算溶质和溶剂的质量
[例]欲配制质量百分比浓度为 2%AgNO3 溶液 500 克,应称取 AgNO3 多少克?加入水多少毫升?
[分析]用 AgNO3 溶液的质量乘以质量百分比浓度,便可得到溶质 AgNO3
的质量;用 AgNO3 溶液的质量减去 AgNO3 溶质的质量,便可得到应加入水的质量;用水的质量除以水的密度,便可计算出加入水的体积。
[解]应当称取 AgNO3 的质量为:
500 克×2%=10 克
应当加入水的质量为: 加入水的体积为:
500 克-10 克=490 克
490 克÷1 克/毫升=490 毫升
答:配制 2%AgNO3 溶液 500 克应称取 AgNO310 克,加入水 490 毫升。
③关于溶液稀释的计算
[例]配制质量百分比浓度为 20%,溶液密度为 1.14 克/厘米 3,体积为
500 毫升的稀硫酸,需要量取质量百分比浓度为 98%,密度为 1.84 克/厘米 3
的浓硫酸多少毫升?
[分析]溶液在稀释过程中,溶液的体积和浓度都会发生变化,溶液中所含溶质的质量却始终保持不变。即
原溶液中所含溶质的质量=稀释后溶液中所含溶质的质量运用这一规律,各种类型的溶液稀释计算,均可正确求解。
[解]设量取 V 毫升的浓硫酸,则浓硫酸中所含溶质的质量为:
V×1.84×98%
稀硫酸溶液中所含溶质的质量为:
500×1.14×20%
按照溶液稀释过程中溶质质量保持不变,可以列出下列等式:
V×1.84×98%=500×1.14×20%
V=63.22(毫升)
所需水的质量为:
所需水的体积为:
500-63.22×1.84=383.67(克)
383.67克
1克 / 毫升
= 383.67毫升
[注意]进行溶液稀释(或混合)计算时,溶液与溶剂(或另一溶液) 的质量可以相加,其体积不能相加。
答:需要量取浓硫酸 63.22 毫升,量取水 383.67 毫升。
溶解度与质量百分比浓度的换算 溶解度是表示一定温度下的饱和溶液里溶剂质量与溶质质量的关系;质量百分比浓度是表示任何溶液(饱和溶液或不饱和溶液)里溶液质量与溶质质量的关系。溶解度与质量百分比浓度的换算,是对一定温度下的饱和溶液而言,溶解度的分母是溶剂质量,质量百分比浓度的分母是溶液质量。
①已知溶解度计算质量百分比浓度
[例]在 30℃时,CuSO4 的溶解度是 25 克,计算该温度下硫酸铜饱和溶液的质量百分比浓度是多少?
[分析]30℃时CuSO4 的溶解度是 25 克,说明在100 克水中溶解25 克CuSO4
时,可以形成该温度下硫酸铜饱和溶液。根据溶质 CuSO4 的质量是 25 克,溶液质量是 125 克,便可计算出硫酸铜饱和溶液的质量百分比浓度。
[解]
质量百分比浓度 = 溶质质量 ×100%
溶液质量
= 25克 ×100% 100克 + 25克
= 20%
答:30℃时 CuSO4 饱和溶液的质量百分比浓度是 20%。
②已知饱和溶液的质量百分比浓度计算该温度下溶质的溶解度
[例]在 30℃时硫酸铜饱和溶液的质量百分比浓度是 20%,计算该温度下CuSO4 的溶解度是多少克?
[分析]从 30℃时硫酸铜饱和溶液的质量百分比浓度是 20%,可知当溶
液质量为 100 克时,溶质质量为 20 克,则溶剂的质量为:
溶剂质量=溶液质量-溶质质量
=100 克-20 克=80 克
知道了饱和溶液里溶质的质量和溶剂的质量,便可计算出 30℃时 CuSO4 的溶解度。
[解]30℃时 CuSO4 的溶解度为:
溶质质量 20
溶剂质量 ×100 = 100 - 20 ×100 = 25(克)
答:30℃时 CuSO4 的溶解度是 25 克。
溶液析晶计算 正确运用溶解度和浓度概念,算出原溶液里溶质和溶剂的质量;依据题给条件,找出析出晶体后溶液里的溶质与溶剂的质量关系; 把握住析晶后的溶液肯定是该物质在该温度下的饱和溶液。抓好以上三点, 对于各种条件下的溶液析晶计算,都可以用简单方法求出析出晶体的质量。
①饱和溶液降温析出晶体的计算
[例]已知 72℃时 KNO3 的溶解度为 140 克,18℃时 KNO3 的溶解度为 30 克。现有 72℃饱和 KNO3 溶液 48 克,当冷却至 18℃时析出晶体多少克?
[分析]从 72℃KNO3 的溶解度是 140 克,可知在 100 克水中能溶解KNO3140 克,按照溶剂质量与溶质质量之和等于溶液质量,可知在 240 克硝酸钾饱和溶液中含有 KNO3140 克,当冷却至 18℃时,可以析出 KNO3(140-30)克,运用正比例关系,就可计算出 72℃时 48 克 KNO3 饱和溶液冷却至 18℃时析出晶体的质量。
[解]设 72℃时 48 克 KNO3 饱和溶液冷却至 18℃时析出晶体的质量为 x
克。
溶液质量 析晶质量
100克+ 140克 = 140克- 30克
48克 x
x=22 克
答:冷却至 18℃析出晶体 22 克。
②蒸发饱和溶液中水分析出晶体的计算
[例]已知 70℃时 NH4Cl 的溶解度是 60 克,若将 320 克 70℃的 NH4Cl 饱和溶液,加热蒸发 40 克水之后,再冷却至 70℃时,有多少克 NH4Cl 晶体析出?
[分析]在一定温度下,饱和溶液蒸发溶剂析出的晶体质量,就是被蒸发的溶剂质量所能溶解溶质达于饱和时的质量。这样,只需运用溶剂质量与溶质质量的关系,便可计算出蒸发水分析出的晶体的质量。
[解]设蒸发 40 克水析出 NH4Cl 晶体为 x 克
溶剂质量 溶质质量
100克 = 60克
40克 x
x=24 克
答:蒸发 40 克水可析出 24 克 NH4Cl 晶体。
③不饱和溶液蒸发水分和降低温度的析晶计算
[例]今有 40℃时 250 克 20%KNO3 溶液,蒸发 150 克水,仍保持 40℃时可析出 KNO3 多少克?若降温至 10℃时,又能析出 KNO3 多少克?
[分析]在 250 克 20%的 KNO3 溶液中,含有溶质 KNO3 的质量为:
250 克×20%=50 克
含有溶剂的质量为:
250 克-50 克=200 克
从溶解度曲线查出 40℃KNO3 溶解度是 64 克,10℃KNO3 溶解度是 20 克,由此可知 40℃时 20%的 KNO3 溶液是不饱和溶液。对于不饱和溶液蒸发水分的析晶计算,要用原溶液里含有的溶质质量减去剩余水中溶解的溶质质量。
[解]在 250 克 20%的 KNO3 溶液中,含有溶质 KNO3 50 克,溶剂 200 克,
蒸发 150 克水后,溶液里剩余水的质量为:
200 克-150 克=50 克
50 克水在 40℃时可溶解 KNO3 为 x 克
溶剂质量
KNO3 质量
100克 = 64克
50克 x
在 40℃时可析出 KNO3 的质量为:
x=32 克
50 克-32 克=18 克
设继续降温至 10℃时,析出 KNO3 的质量为 y 克。
溶液质量 溶质质量
100克 + 64克 = 64克 - 20克
50克 + 32克 y
y=22 克
共析出 KNO3 的质量为:
18 克+22 克=40 克
答:250 克 20%KNO3 溶液蒸发 150 克水并冷却至 40℃析出 KNO318 克,继续降温至 10℃时又析出 KNO322 克,共析出 KNO340 克。
④析出含水晶体的计算
[例]浓度为 15%的硫酸铜溶液 500 克,在加热蒸发 300 克并冷却至 20℃ 时,可析出蓝矾晶体(CuSO4·5H2O)多少克?(在 20℃时 CuSO4 的溶解度是20 克)
[分析]本题硫酸铜溶液中的溶质是 CuSO4,析出的晶体是 CuSO4·5H2O。
计算析晶后溶液里含有的溶质质量时,要先把析出的含水晶体 CuSO4·5H2O 的质量,换算为无水晶体 CuSO4 的质量,再用原溶液里总溶质质量减去换算为无水晶体 CuSO4 的质量;在计算析晶后溶液里含有的水的质量时,又要减去析出含水晶体 CuSO4·5H2O 带走的结晶水的质量。
[解]原硫酸铜溶液里含有的溶质 CuSO4 的质量是:
500 克×15%=75 克
含有的溶剂 H2O 的质量是:
500 克-75 克=425 克
当蒸发 300 克水并冷却至 20℃析出 CuSO4·5H2O 的质量为 x 克时,析晶后溶液中的溶质 CuSO4 的质量是:
75克 − x· 160 克
250
析出 x 克 CuSO4·5H2O 后溶液中水的质量是:
425克- 300克- x·
90
250 克
依据析出 x 克 CuSO4·5H2O 后的溶液是该温度下的饱和溶液,可列出如下比例关系
75克 − x· 160 克
溶质: 250 = 20 克
溶剂: 425克 − 300克− x·
x=88 克答:可析出 CuSO4·5H2O 88 克。
90
250 克
100克
根据化学方程式计算有关反应物或生成物的质量 化学方程式可以表示在该化学反应中,各反应物与生成物间的质量关系,是进行化学计算的依据。根据化学方程式的计算,一般按以下三步进行:
第一步 认真审题,依据题意写出正确的化学方程式。
第二步 深入析题,充分认清已知条件和未知求问,找出已知条件和未知求问间的联系,并写在化学方程式有关物质化学式的下方。
第三步 根据化学方程式各物质的质量关系,列出比例式,具体完成该题的计算。应该做到解题要有根据,解法要规范,书写要工整,答案要确切。
①计算反应物或生成物的质量
[例]由红磷燃烧制取五氧化二磷,现有红磷 0.62 克,若充分反应可制取五氧化二磷多少克?需耗用标准状况下的氧气体积为多少升?(标准状况下氧气的密度是 1.429 克/升)
[分析]化学方程式所表示的是各物质的质量关系
4P+5O2
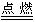 2P2O5
2P2O5
4×31 克 5×32 克 2×142 克
依据红磷完全燃烧的化学方程式,可知 124 克红磷完全燃烧需耗用氧气 160
克,生成五氧化二磷 284 克。题目给出红磷质量是 0.62 克,用正比例关系, 可以计算出生成五氧化二磷的质量和耗用氧气的质量。
[解]设 0.62 克红磷完全燃烧生成 x 克五氧化二磷,耗用 y 克氧气。4P+5O2
 2P2O5
2P2O5
4×31克 = 5×32克 = 2×142克
0.62克
y x
x=1.42 克y=0.80 克
0.80 克氧气在标准状况下占有的体积为:
0.80克 = 0.56升
1.429克 / 升
答:0.62 克红磷完全燃烧需耗用标准状况下氧气 0.56 升,生成五氧化二磷 1.42 克。
②计算物质的纯度
[例]含有铁锈(主要成分是 Fe2O3)的铁粉质量为 7.0 克,跟足量稀盐酸充分反应后,生成氢气 0.2 克,计算该铁粉的纯度。
[分析]铁粉跟稀盐酸发生置换反应,生成氯化亚铁和氢气
Fe+2HCl=FeCl2+H2↑
根据生成 H2 的质量可以计算出 Fe 的质量,再用 Fe 的质量除以不纯铁粉的质量,乘以 100%,便可得出该铁粉的纯度。
[解]设该铁粉中含 Fe 为 x 克
Fe+2HCl=H2↑+FeCl2
56克 = 2克
x 0.2克
x=5.6 克
该铁粉的纯度为:
5.6克
7.0克 ×100% = 80.0%
答:该铁粉的纯度为 80%。
根据化学方程式计算反应物或生成物的质量百分比浓度 这种计算的特点是把质量百分比浓度与化学方程式的计算结合起来。进行这种类型的计算,先要依据化学方程式,计算出反应物或生成物的质量;再分别除以各自溶液的质量,就可以计算出反应物或生成物的质量百分比浓度。
[例]含有 Al2O3 的 Al 粉 3 克,已知 Al 的百分含量为 90%,该铝粉跟质量为 100 克的稀硫酸恰好反应完全,计算稀硫酸的质量百分比浓度是多少?所得 Al2(SO4)3 溶液的质量百分比浓度是多少?
[分析]把含有 Al2O3 的 Al 粉放入稀硫酸中,发生的化学反应是: 2Al+3H2SO4=Al2(SO4)3+3H2↑ Al2O3+3H2SO4=Al2(SO4)3+3H2O
在 3 克铝粉(内含 Al2O3)中含有铝(Al)的质量为:
3 克×90%=2.7 克
含有三氧化二铝(Al2O3)的质量为:
3 克×(1-90%)=0.3 克
跟 2.7 克 Al 反应的 H2SO4 与跟 0.3 克 Al2O3 反应的 H2SO4 的质量之和,是稀H2SO4 中的溶质质量,据此可以计算出稀硫酸的质量百分比浓度。
2.7 克 Al 跟 H2SO4 反应生成的 Al2(SO4)3 与 0.3 克 Al2O3 跟 H2SO4 反应生成的 Al2(SO4)3 的质量之和,是 Al2(SO4)3 溶液中 Al2(SO4)3 溶质的质量,据此可以计算出所得 Al2(SO4)3 溶液的质量百分比浓度。
[解]设跟 2.7 克 Al 反应的 H2SO4 为 x1 克,生成 Al2(SO4)3 y1 克,产生 H2z1 克;跟 0.3 克 Al2O3 反应的 H2SO4 为 x2 克,生成 Al2(SO4)3 y2 克,生成水 z2 克。
2Al+3H2SO4=Al2(SO4)3+3H2↑
2×27克 = 3×98克 = 342克 = 3×2克
2.7克 x1 y1 z1
x1=14.7 克y1=17.1 克z1=0.3 克
Al2O3+3H2SO4=Al2(SO4)3+3H2O
102克 = 3×98克 = 342克 = 3×18克
0.3克 x2 y2 z2
稀硫酸的质量百分比浓度为:
x2=0.86 克y2=1.01 克z2=0.16 克
14.7克 + 0.86克
100克 ×100% = 15.56%
生成 Al2(SO4)3 的质量为:
17.1克 + 1.01克 = 18.11克
Al2(SO4)3 溶液的质量为:
18.11 克+(100-14.7-0.86)克+0.16 克=102.71 克 Al2(SO4)3 溶液的质
量也可用含有 Al2O3 的铝片与稀硫酸质量之和,再减去产生的氢气质量算出3 克+100 克-0.3 克=102.7 克
Al2(SO4)3 溶液的质量百分比浓度为:
18.11克
102.71克 ×100% = 17.63%
答:稀 H2SO4 的质量百分比浓度是 15.56%,Al2(SO4)3 溶液的质量百分比浓度是 17.63%。
