怎样进行元素化合物知识的教学
元素化合物知识是化学教学内容的重要组成部分,在现行教材中元素化合物知识在数量上占整个教材的五分之三;在教学大纲中明确提出重视元素化合物知识的教学。
元素化合物知识是中学化学知识构成的基础。中学化学知识的构成包括六大部分。其中化学基本概念,基本理论是以元素化合物知识为基础导出的,如果学生不掌握物质的性质及其变化,化学基本理论将成为无本之木。通过元素化合物的教学加深对理论的理解,使理论知识得到巩固和应用,起到相辅相成,共同提高的作用;化学实验是对元素化合物知识的生动再现,认识和探讨物质新属性、探讨新理论的基本方法; 化学计算是对元素化合物知识的定量研究;化学用语则是对元素化合物知识记录和描述。
为解决科学知识量的激增和日益增长的社会要求的需要,把培养能力列为教学内容,是理科教育现代化的标志。化学教育里能力培养,就是遵循和运用有关的教学原则和方法,通过自然科学方法的基本步骤学习化学基础知识,元素化合物知识是学习化学基础知识的起点,而经过科学的抽象、概括,得出结论后,又要将结论运用于实践重新用到元素化合物知识上。在元素化合物知识的教学过程中,同时培养学生对化学实验现象的观察能力;透过现象分析事物变化实质,从感性到理性的认知过程中培养学生的思维能力,自学能力;在验证理性认识是否正确、完整的过程中培养学生的实际操作能力和创造能力,同时通过物质及它们的变化和变化条件的学习,培养学生的辩证唯物主义观点。
一、元素化合物知识的内容和分类
在现行的中学化学教材里,总共介绍了具有代表性的元素 20 多种及
重要的化合物 80 多种。这些元素化合物知识基本上是按元素周期表系统安排的,从主族到副族、从纵向元素族到横向周期律,从无机化合物到有机化合物。并且把元素化合物知识和基本理论知识穿插编排。其中重点学习 13 种元素:5 种金属元素,分别是钠、镁、铝、铁、铜。8 种非金属元素,分别是氯、氧、硫、氮、磷、碳、硅、氢。
(一)元素化合物知识内容1.金属元素知识的系统
单质→氧化物→氧化物对应水化物→金属相对应的盐。
例如Na→
Na2 O →NaOH→ Na2 CO3
Na2 O2
Al→Al2 O3→Al(OH) 3
NaHCO3 Al2 ( SO4 ) 3
NaAlO2
Fe→Fe O → Fe(OH ) 2 → FeCl2
3 4
Fe2 O3
Fe(OH ) 3
FeCl3
- 非金属元素知识系统
对应盐←氢化物←单质→氧化物→氧化物对应的水化物→非金属相应的含氧酸盐
例如
NaCl←HCl←Cl2
→HClO→
NaClO Ca(ClO) 2
FeS←H S←S→ SO2 → H 2 SO3 → Na2 SO3
2 SO3 H2 SO4 Na2 SO4
NH Cl←NH ←N →
NO → HNO2 →
KNO3
4 3 2 NO2 HNO3
Ca( NO3 ) 2
PH3←P→P2 O 5→
H3 PO4 HPO3
Na3 PO4 Ca3 ( PO4 ) 2
Ca( H2 PO4 )2
- 元素化合物知识的内容要点
以基础理论为指导,学习元素及其化合物的性质、存在、用途,制取和检验是元素化合物知识的内容。物质的性质反映着物质的结构、决定着物质的用途、制取、存在和保存等,因此元素化合物知识中每一种物质以化学性质为核心进行教学。它们的关系为
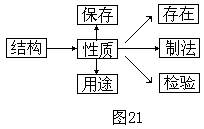
(二)元素化合物知识分类
一般以元素化合物知识位于教材物质结构、元素周期律知识的前后位置不同,以及在学习过程中逻辑思维方法的不同,把元素化合物知识分为“理论前”元素化合物知识和“理论后”元素化合物知识两大类别。
- “理论前”元素化合物:位于物质结构、元素周期律之前的元素化合物知识
初中化学较系统地介绍了氢、氧、碳等非金属元素以及氧化物,碱、酸、盐各类化合物的通性。高中化学则进一步介绍卤素、氧族(硫和硫酸):碱金属,逐步形成元素族的概念。为系统地学习物质结构和元素周期律提供了感性认识的基础。“理论前”元素化合物知识在学习过程中思维方法是由个别到一般、由具体到抽象的归纳法。例如由个别酸的性质,经过去异求同归纳出酸的通性;由个别碱的性质,归纳出碱的通性。由卤素中典型的个别元素如氯及化合物的性质,归纳出卤族元素及化合物的某些共性,同样以硫及其化合物的性质去认识氧族元素的共性。这一学习过程培养学生用归纳法进行逻辑思维的能力。
- “理论后”元素化合物:即位于物质结构、元素周期律之后的元素化合物知识。
这类教材主要包括高中化学里氮和磷、硅、镁、铝、铁和有机物。在教学过程中要运用所学的物质结构和元素周期律理论知识,从原子结构揭示不同元素原子结构的差异及联系,确定元素在元素周期表中的位置,进一步概括出元素的金属性或非金属性及其主要化合物的性质。在
学习过程中体现用理论指导元素化合物知识的学习,同时元素化合物知识的学习又使理论得到巩固和深化,使“结构”、“位置”“性质”三者的关系得到统一。“理论后”元素化合物知识的认识过程中主要采用由一般到个别的认识规律;由抽象到具体的演绎法。例如学习氮族元素从原子结构,周期表中位置可推测氮族元素的非金属性较弱;再具体到氮气从化学性质来看明显比氧气的氧化性弱,这一现象学生由物质结构“N≡N”叁键得到进一步解释。在教学过程中由抽象到具体用演绎推理的方法获得新知识,有助于学生智力的发展,同时培养演绎推理能力。
二、元素化合物知识教学要求
元素化合物知识是描述性的化学知识,内容庞杂、材料琐碎、涉及的化学现象和各种化学反应较多,再加上不容易记忆,使学生在学习中感到知识杂乱,而思维潜力没有得到发挥,在综合运用知识解决实际问题时又感到束手无策。有的学生则把精力用在机械记忆上、死背硬记化学反应。因此搞好元素化合物知识的教学,必须充分认识元素化合物教学的特点和要求。
- 运用基础理论,使元素化合物知识系统化
在中学化学教材中虽然注意了元素化合物知识与理论知识的互相穿插,但是教师在教学过程中首先要明确基础理论与元素化合物知识之间相辅相成的辩证关系。在教学过程中应体现以基础理论为指导,以元素化合物知识为主体的教学思想。要重视对元素化合物知识的宏观现象和理论知识中的微观结构的结合,突出元素化合物自身知识体系,用基础理论揭示元素及化合物性质变化的内在规律。并且在基础理论的指导下,使元素化合物知识系统化和深刻化,使学生形成巩固的系统知识。必将使学生对基本理论的理解得到巩固和加深。
在教学中要抓住物质的结构这条主线,突出物质的化学性质这一重点,通过理解、推导让学生自觉地去掌握元素及化合物知识,克服死记硬背的学习方法。例如,过渡元素铁常有可变化合价,在化学反应中铁何时呈+2 价;何时呈+3 价这就应结合铁的原子结构去认识。化学反应中铁可以失去最外层的 2 个电子而呈+2 价,也有可能再失去次外层的 1 个电子而呈+3 价。铁的自身性质是由结构决定的,而化学反应中铁呈几价又必须依据氧化剂性质的强弱而定。铁遇强氧化剂(Cl2、Br2、HNO3(过量)⋯⋯)呈+3 价,而铁遇弱氧化剂(S、I2,H2SO4(稀),HCl 等)呈
+2 价。Fe2+遇强氧化剂(Cl2、Br2,HNO3 等)变为 Fe3+;而 Fe3+遇还原剂
(Fe、Cu、H2S、HI 等)变为 Fe2+。铁及铁的化合物知识可系统化为:
图 22
氢氧化铝是两性氢氧化物,它的性质和制取是教学中的重点也是难点。如果我们从氢氧化铝是弱电解质,有酸式电离和碱式电离以及加酸或加碱引起电离平衡的移动来讲解,学生就能较顺利地掌握由铝盐制取氢氧化铝只能选用可溶于水的弱碱氨水。若在铝盐中加入强碱溶液,例如 Al2(SO4)3 和 NaOH 溶液反应必有下列反应:Al3++3OH-=Al(OH)3
↓
Al 3+ + 4OH - = AlO-
+ 2H2 O
它表示适量的碱使溶液中 Al3+沉淀,而过量的强碱又可使产生的沉淀完全溶解。并且还揭示了 OH-与 Al3+在发生不同化学反应时它们物质的量之比。同理用偏铝酸盐溶液制氢氧化铝只应在溶液中通入二氧化碳气体。若改用盐酸等强酸,必然有下列反应
AlO- + H+ + H O = Al(OH) ↓
AlO-
+ 4H+
= Al 3+ + 2H O
因此不论是物质结构,元素周期律,电解质理论,化学平衡理论都可以指导元素化合物知识的学习;使学生获得的元素化合物知识系统化和深入化。
- 全面正确掌握元素化合物的知识体系和自身的内在联系
元素化合物知识具有丰富的内容;也显得多而杂。因此全面正确掌握元素化合物的知识体系和自身的内在联系是十分必要的。正像美国教育心理学家布鲁纳提出“教学论必须探明显示教材的最优程序的问题, 也就是探明教学过程的问题”。布鲁纳向我们提示:知识的教学一要遵循知识的逻辑规律,二要遵循学生的认知规律
- 确定元素化合物知识体系
元素化合物知识教学对每种物质一般都依照金属或非金属元素知识体系中,单质→氢化物及氢化物对应的盐→氧化物→氧化物对应的水化物→含氧酸盐的顺序进行学习和研究的。在教学中它们就是元素化合物知识的体系(知识主线)。使学生掌握这一知识主线也就把握学习和研究元素族的知识系统和方向;改变学生只能被动获得知识的地位。知识体系揭示了所有元素族具有的相似性,有利于学生进行知识的迁移,也有利于元素化合物知识点的确定(即知识体系中的每种具体物质成为重要的知识点)。
- 知识点教学既要全面,又要抓好内在联系确定重点
我们必须明确物质的性质反映着物质的结构,物质的性质决定物质的制法、用途、保存和检验这一元素化合物知识的自身体系。因此物质的性质(特别是化学性质)是贯穿在各知识点教学中的核心,在教学中以结构理论带性质,抓性质带制法,用途,保存和检验。
在元素化合物化学性质的教学中;要抓好①非氧化还原反应中,所表现的物质的酸性或碱性(或酸性氧化物、碱性氧化物的属性)。②氧化还原反应中,所表现的物质的金属性、非金属性、氧化性、还原性。
③其他反应的典型属性。使每个知识点教学内容全面。
例如二氧化硫的化学性质:①酸性氧化物可以和水、碱、碱性氧化物反应②具有还原性可以和氧化剂如氧气、卤素单质;强氧化性酸,高锰酸钾等反应③具有较弱的氧化性与强还原剂硫化氢反应④使品红溶液褪色有漂白性。以图示表示该知识点
图 23
又如在氨的化学性质中①非氧化还原反应(和水、酸以及作为络合
−3
剂)②氧化还原反应中,氨中 N 的还原性。硝酸的化学性质①酸的通性
②强氧化性③不稳定性④与有机物发生酯化反应或硝化反应。
图示法简捷明了地表示了物质的化学性质及需要掌握的重点知识, 便于学生的理解和记忆。
- 每章教学的最后用知识网概括同种元素不同价态的物质间的相互关系,既有知识点又有知识面从点面结合上深入元素化合物知识的学习。
图 24
图 25
例如,铝及其化合物知识网
图 26
铝及其化合物知识网
知识网将各知识点连接成一个整体,它以简明的图示揭示知识整体的关系,又表示各物质的性质和制取。知识网容易被学生接受,利于激发兴趣,诱导求知,元素化合物知识体系、知识点、知识网的探求是对教材最优结构化的探讨。
图 27
- 重视实验和其它直观教学手段的运用
大量的物质性质和制备方法的学习,可以通过化学实验或其它直观手段来完成。在实验中学生获得鲜明、深刻的感性认识,再通过分析、抽象、概括、推理、论证等逻辑思维方法认识物质的性质和结构的关系。
化学实验在化学教学中的作用是多重的。它不仅是学生学习化学知识、掌握实验技能、发展智力、培养能力的基本途径,而且是培养学生科学态度,良好情感意志品质等的最重要的手段,还是使学生形成科学世界观、养成科学方法的最佳途径。因此做好演示实验及学生实验以及改进一些实验是十分必要的。具体方法:
-
让学生操作一些比较简单的演示实验。它有利于把全体学生的注意力吸引到化学实验上,既有利于观察实验现象,又有利于培养学生掌握正确的实验技能。
-
把某些演示实验改为“并进实验”。它不仅使学生得到动手实验的机会,而且培养学生边观察边思考的好习惯,同时有利于理解和记忆。
-
增加一些简便、有启迪性的实验,以利深入理解物质的性质。例如,为加深对高中化学 (必修)第一册化学反应: Br2+SO2+2H2O=2HBr+H2SO4 的理解。并认识 SO2、Na2SO3 的还原性及卤素单
质的氧化性进行实验。
①把 SO2 通入溴水或碘水中,两溶液褪色。
②把 SO2 通入蓝色的 I2 淀粉溶液中,蓝色褪去。
③碘水中滴加 Na2SO3 溶液,碘水褪色。
④Na2SO3 溶液滴加盐酸酸化的 BaCl2 溶液无沉淀。Na2SO3 溶液,滴加溴水或碘水再滴加盐酸酸化的 BaCl2 溶液却有白色沉淀。
- 对于不能直接观察到实验现象的教学内容,要充分利用模型、挂图、标本等直观教具及录像等辅助教学。
- 培养和提高学生的能力
元素化合物知识的教学过程是教师引导学生掌握物质知识,把知识转化为能力的过程。现代教学观以发展学生能力为教学目标之一,通过知识的教学发展学生的能力。
-
通过阅读教材提高学生的阅读能力和自学能力。在教师的指导下训练学生的阅读能力时,要注意阅读的速度,还要指导学生在阅读中做标记、划重点、写小结以提高自学能力。
-
观察能力和思维能力的培养。在观察化学实验时应注意培养观察的目的性、整体性、精确性。从生动的直观到抽象思维,再从抽象的思维到实践是认识真理获得知识的途径,思维能力是发展智力的突破点。
例如,在 NaCl,NaBr、NaI 的晶体中分别加入浓硫酸,依次观察到白雾,白雾和红棕色气体,几乎没有白雾只有些黑色固体。分析反应的共性,均为由高沸点酸制备低沸点酸。低沸点的氢卤酸中卤素的阴离子还原性按 Cl-,Br-,I-依次增强,浓硫酸作为强氧化剂基本将 I-全部氧化为 I2;使部分 Br-氧化为 Br2;不能将 Cl-氧化为 Cl2。
又如将等质量的 Na2CO3 和 NaHCO3 分别放入等量(足量)的盐酸中, 观察到产生的气体后者速度快,且数量多(用气球收集)。分析上述现
象得出HCO- 比CO2- 更易结合H + (可以用弱电解质的电离理论解
3 3
释)因此 NaHCO3 反应速度快。NaHCO3 产生的气体多,则从定量计算结果说明。在学生掌握一定量的化学知识基础上,通过解决化学问题就可以培养学生的思维能力。
- 注意培养学生的创造能力
①知识迁移。元素化合物知识的教学中多采用以点带面,举一反三的途径进行教学。例如卤素中以氯为典型,用知识迁移方法学习氟,溴、碘的知识。在知识迁移时要注意它们和典型元素的相似性及递变性。
②设计实验的能力。在学生掌握化学知识和实验技能的基础上给出一些实验习题,培养学生设计实验的能力。例如,请学生设计实验证明二氧化硫气体中混有二氧化碳气体。证明红热的炭和水反应有一氧化碳和氢气生成。
③鼓励和培养学生创新意识。高中化学必修本第一册指出:用可溶性钡盐溶液和盐酸(或稀硝酸)可以检验硫酸
根离子的存在。学生讨论这段教材时指出,若溶液中有Ag+ 而无SO2-加
入BaCl
可以观察到相同的现象。若无SO2- 而有SO2-离子加入硝
2 4 3
酸酸化的可溶性钡盐也有同样的现象。对学生指出教材上不够严谨的地方应给予鼓励,并引导它们创新。
一个人在化学专业中、在事业上,能否发展,取得成就,并不完全取决于掌握化学知识的多少,在很大程度上取决于化学认知过程中的思想、方法、精神及能否灵活解决化学问题和进行发明创造。化学教学的
要点是让学生主动获得知识,全面提高各种能力,使每个学生都得到充分发展。
