怎样进行化学用语的教学
化学用语是中学化学基础知识的重要组成部分,是教师向学生传播化学知识的媒介,是学生掌握化学知识必不可少的工具,同时也是科学研究、学术交流的一种手段。
化学用语是国际统一规定用来表示物质的组成、结构和变化规律的符号。它具有简明直观,概括力强的特点,也有助于培养和发展学生的抽象思维和理解力。因此,化学教师如何深入理解化学用语的概念内涵, 准确而熟练地运用化学用语,掌握化学用语的教学规律、方法和特点是实现双基教学的关键。
一、化学用语的起源
1808 年,道尔顿在化学中首先开始使用基于原子论观点的、表示元素原子和化合物的符号,即所谓道尔顿符号。画出了一些原子和化合物的表示符号共 37 个。如:
元素 氢 氮 碳 氧 磷 硫 铁 锌 铜符号
化合物 水 氨 一氧化碳 碳酸符号
1819 年,柏齐里乌斯倡议并开始使用元素拉丁文名称第一个字母表示元素,他建议:用简单的字母表示主要的非金属元素,用附加第二个小写字母的办法来区分那些第一个字母相同的金属或其它非金属元素。至今使用的化学符号就是在柏齐里乌斯倡议的原则基础上形成的符号体系。例如:用 C 表示碳元素,Ca 表示钙元素;S 表示硫元素,Si 表示硅元素;N 表示氮元素, Na 表示钠元素等等。为了便于国际交流,进行规定和统一化学用语的工作,多年来国际纯粹和应用化学联合会(IUPAC) 开展了大量工作;我国化学会和科学院均设立专门机构,从事化学名词的翻译和规定工作。中学化学课本中的元素符号都是世界各国所公认、统一的。
二、化学用语的分类和相关的内容
在中学化学中,化学用语主要包括化学符号、化学式、化学方程式、化学图式四个部分。它是按现行中学化学课本知识体系有计划有目的地引入的。在初中阶段初步形成体系,在高中阶段得到充分提高。
-
化学符号主要包括:元素符号、离子符号、同位素符号、电子式、根式。
-
化学式主要包括:最简式、分子式、结构式、示性式、同分异构式、用电子式表示分子的结构的化学式、用配位键结合的络合物、用氢键表示的化合物。
-
化学方程式主要包括:化学方程式、氧化还原反应方程式、电离方程式、离子方程式、热化学方程式、可逆反应方程式、可逆反应通式、电极反应方程式、盐类水解反应方程式、用电子式表示分子形成过程的
式子。
- 化学图式主要包括,化合物的分子图式、原子结构示意图、离子结构示意图、原子和离子的轨道表示式、共价分子轨道表示式、电子排布式、电子云图、电子云界面图、电子云径向分布图、电子云的角度分布图、晶体结构图。
对于每一种化学用语,都要明确它们的表示方法和表示的意义。例如:乙炔和苯的最简式的表示方法为 CH,它表示的意义是:表示组成物质的各种元素和各种元素的原子个数最简整数比。又如:盐酸和氢氧化钠反应的离子方程式为:H++OH-=H2O 它是用实际参加反应的离子的符号来表示离子反应。表示的意义是:表示离子间的反应;表示同一类型的离子反应的实质。因此,教师要统观全局,理清脉络,认清各种化学用语的特点,比较各自的异同点以及它们之间的相互联系。在初中化学教学中就要打好一定的基础,然后在此基础上有计划有步骤地引入和讲清新的化学用语,这样,从整体着眼,从具体入手,环环扣紧,严格要求, 就能收到较好的效果,完成化学用语教学目标中确定的教学任务。
三、在化学用语教学中应注意的几个问题
- 从化学教学起始阶段就要不断渗透有关化学用语的知识内容。 对于元素符号、化学式、化学方程式,学生过去从没接触过,但又
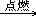 是教学中的难点,学生往往感觉枯燥无味,认为记元素符号是一种“苦差事”,教师不妨采取一些教学的超前措施,避免学到后面《元素》一节内容时,大量元素符号一起呈现在学生面前,并要求他们一下子熟记,
以至挫伤他们学习化学的积极性。为了分散难点,提高学生学习兴趣,
要从“绪言”一节开始,就有选择地给出一些元素符号和一些物质的化学式。例如:银白色金属镁带,点燃后能在空气中燃烧,生成了白色粉末状物质氧化镁。在课本中用文字表示如下:镁+氧气
是教学中的难点,学生往往感觉枯燥无味,认为记元素符号是一种“苦差事”,教师不妨采取一些教学的超前措施,避免学到后面《元素》一节内容时,大量元素符号一起呈现在学生面前,并要求他们一下子熟记,
以至挫伤他们学习化学的积极性。为了分散难点,提高学生学习兴趣,
要从“绪言”一节开始,就有选择地给出一些元素符号和一些物质的化学式。例如:银白色金属镁带,点燃后能在空气中燃烧,生成了白色粉末状物质氧化镁。在课本中用文字表示如下:镁+氧气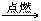 氧化镁
在教学中可告知学生:在化学中,镁用符号 Mg 表示,氧气用符号 O2 表示,氧
氧化镁
在教学中可告知学生:在化学中,镁用符号 Mg 表示,氧气用符号 O2 表示,氧
化镁用 MgO 表示。那么这个化学变化就可表示为:Mg+O2 MgO(这里不要求配平),并说明这种表示化学反应的式子,是一种国际通用的化学书面语言。促使学生学习行为的有的性。习读成镁和氧气在点燃的条件下反应生成氧化镁。在这个反应里,我们认识了二个元素符号 Mg 和 O, 二个化学式 O2 和 MgO,紧接着在第一章空气、氧气中,我们又学习了氧气的化学性质,又认识了氮 N、碳 C、硫 S、铁 Fe、磷 P、铜 Cu、铝 Al 等元素符号。同时又认识了二氧化碳 CO2、二氧化硫 SO2、四氧化三铁Fe3O4、五氧化二磷 P2O5、氮气 N2 等化学式。并会写出碳、硫、铁、磷与
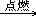
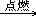 氧气反应的式子,如:C+O2
CO2,S+O2 SO2 等。为后面学习化学方程式打下了基础。
氧气反应的式子,如:C+O2
CO2,S+O2 SO2 等。为后面学习化学方程式打下了基础。
这样,从一开始学习化学就渗透化学用语,学生容易接受,不吃力,
反而很感兴趣,了解到化学中的这些符号成为化学这门课的特点,是学习化学的工具。
在集中学习元素符号时,可以在已经熟悉部分元素符号的基础上,

 把中学常用的
27 种元素中最常见的 17 种元素编成三句韵律语:碳 C 氢 H氧 O 氮 N 氯 Cl 硫
S 磷 P,钾 K 钙 Ca 钠 Na 镁 Mg 铝 Al 铁 Fe 锌 Zn,再加三个铜 Cu 汞 Hg 银
Ag。然后每节课抽出 5 分钟默写几个元素符号和化学式,并要求学生做“元素名称
元素符号”,“物质名称 化学式”的互现练习。同时把易混淆的元素如:H 和
He,Al 和 Cl,Mg 和 Hg,Hg和 Ag
等穿插进去,使学生在变式练习中加深记忆达到熟练掌握的目的。随着知识的积累,要求学生每见到一个物质的化学式,就要说出它
把中学常用的
27 种元素中最常见的 17 种元素编成三句韵律语:碳 C 氢 H氧 O 氮 N 氯 Cl 硫
S 磷 P,钾 K 钙 Ca 钠 Na 镁 Mg 铝 Al 铁 Fe 锌 Zn,再加三个铜 Cu 汞 Hg 银
Ag。然后每节课抽出 5 分钟默写几个元素符号和化学式,并要求学生做“元素名称
元素符号”,“物质名称 化学式”的互现练习。同时把易混淆的元素如:H 和
He,Al 和 Cl,Mg 和 Hg,Hg和 Ag
等穿插进去,使学生在变式练习中加深记忆达到熟练掌握的目的。随着知识的积累,要求学生每见到一个物质的化学式,就要说出它
是由哪些元素组成的。如:H2O,是由氢元素和氧元素组成的;CO2,是由碳元素和氧元素组成的;NH4HCO3 是由氢元素氮元素碳元素氧元素四种元素组成的。
这种在起始课就开始渗透化学用语的教学方法是行之有效的,为后面学习元素符号、化学式、化学方程式的含义奠定了基础。
- 了解化学用语表示的意义,是学好化学用语的关键
学生不但要能正确书写元素符号、分子式和化学方程式,更重要的是要掌握化学用语的意义。如:要让学生见到 CO2 这个分子式时,要知道它表示的意义应有以下 10 个方面:
-
表示二氧化碳
-
表示二氧化碳是由碳元素和氧元素组成的。
-
表示碳、氧元素质量比为 3∶8。
-
表示 1 个二氧化碳分子。
-
表示 1 摩二氧化碳分子。
-
表示 1 个二氧化碳分子里有 1 个碳原子和 2 个氧原子。
-
表示 1 摩二氧化碳分子里有 1 摩碳原子,2 摩氧原子。
-
表示二氧化碳的分子量是 44。
-
表示二氧化碳的摩尔质量是 44 克/摩
-
表示在标准状况下 1 摩二氧化碳气体的体积是 22.4 升。
 这样,就使枯燥的二氧化碳分子式变成了活生生的,既有宏观又有微观、既有定性又有定量的事实了。
这样,就使枯燥的二氧化碳分子式变成了活生生的,既有宏观又有微观、既有定性又有定量的事实了。
又如:C+O2 CO2 这个化学方程式,应使学生掌握以下六点含义:
-
表示了碳和氧气反应生成了二氧化碳。
-
表示了反应条件是点燃。
-
表示了碳、氧气、二氧化碳的质量比是 12:32:44,即 3:8: 11。
-
表示了碳、氧气、二氧化碳的微粒个数比或物质的量比是 1:1:
1。
-
表示在同温同压下氧气和二氧化碳气体体积比是 1:1。
-
体现了质量守恒定律。
这样,当学生掌握了这些含义后,不论再做概念判断,还是应用化
学方程式的计算,就找到了依据,再根据题目的具体要求,进行适当的取舍。更重要的是使学生具体明确学习化学用语的目的,意义和要求。
- 化学用语中氧化还原方程式与氧化还原反应概念的关系。
学生在初中初次学习氧化还原反应时,是从得氧、失氧的角度来认识什么是氧化、什么是还原的。在高一时,就要求从化合价升降的角度
认识氧化还原。并要掌握氧化还原方程式的配平。从而也进一步认识了氧化还原反应的本质,是化合价的升降或电子的转移。为了把氧化还原反应学深学透,就要从 6 方面来入手,掌握氧化还原化学方程式反映的有关定性和定量知识内容。
-
要标出电子转移的方向和数目。
-
提出被氧化和被还原的元素。
-
要标出反应中的氧化过程和还原过程。
-
找出氧化剂和还原剂。
-
明确氧化产物和还原产物。
-
有些反应还要定量地分析出起氧化剂作用或起还原剂作用的物质,物质的量是多少。
有利于学生掌握氧化还原反应的本质,掌握氧化还原方程式配平的方法,从而正确地书写氧化还原方程式。
- 化学用语的综合复习
在化学总复习时,要对学过的化学用语通过具体实例做一全面的复习。例如通过对同一微粒的不同表示方法,从而明确它们所代表的不同意义。如:
表 9 元素或微粒的各种符号比较
进一步复习
- 上述微粒中能自相结合成非极性分子的氯原子、氢原子。分子电子式:■
分子结构式:Cl—Cl H—H
用电子式表示氯分子、氢分子的形成过程:
■ H·+■→■
- 上述微粒中能互相结合成极性分子的是氢原子与氯原子结合生成氯化氢分子。
电子式:
结构式:H—Cl
用电子式表示分子形成过程:■
- 上述微粒中能互相结合成非极性分子的是氢原子与碳原子,结合生成的甲烷分子。
电子式: 结构式:
用电子式表示分子形成过程:■
上述微粒中能结合成离子化合物的原子是钠原子与氯原子,结合生成的氯化钠。
电子式:■
用电子式表示离子化合物的形成过程:
■
总之,化学用语的教学,教师要通盘考虑精心组织教学。教学方法上要灵活多样,既要讲解清楚,又要反复练习,提高学习兴趣,提高学习效率。另外还要严格要求在理解其涵义的基础上去记忆,在规范化书
写的训练过程中去识别,在应用中进一步去掌握。
