核外电子 : 1个电子带1个单位负电荷核电荷数 = 核内质子数 = 核外电子数。
表 2-1 几种原子的构成
|
原子种类 |
原子核内 |
核外电子数 |
|
|---|---|---|---|
|
质子数 |
中子数 |
||
|
氢 |
1 |
1 |
|
|
氦 |
2 | 2 |
2 |
|
碳 |
6 | 6 |
6 |
|
氧 |
8 | 8 |
8 |
|
氖 |
10 |
10 |
10 |
|
钠 |
11 |
12 |
11 |
|
镁 12 氯 |
12 17 |
12 18 |
17 |
表 2-1 列出了几种原子的构成情况。
元素 元素就是具有相同核电荷数一类原子的总称。如无论存在于石灰、石膏中的钙,还是钙片中的钙,它们的核电荷数都相同。所以说这些物质中都含有钙元素。
又例如,氧气分子中含有氧原子,二氧化碳分子中含有氧原子,氧化汞分子中也含有氧原子,它们都具有相同的核电荷数。所以说这些物质中都含有氧元素。
科学家已经发现了 100 多种元素,其中人造元素有十几种。它们组成了世界上已知的一千万种物质。元素在自然界里的分布并不均匀。如非洲多金矿,澳大利亚多铁矿,中国富产钨、锌、汞、锡、铅和锑。从整个宇宙来看, 含量最丰富的元素是氢和氦,太阳几乎全由氢和氦组成。地壳(包括大气) 中含量最丰富的元素是氧,几乎占地壳质量的一半,它广泛分布于大气、江海、河流、土壤、岩石中。至于生物体内,氧更是不可缺少的元素。硅是地壳中含量仅次于氧的元素,它大量存在于土壤和岩石中。
各种元素在地壳中的百分含量见图 2-2。

有些元素在地壳中的含量很低,但它们对地球上的生物有着非常重要的意义。例如,碳元素和氮元素分别只占地壳质量的 0.007%和 0.03%,但如果没有碳和氮,地球上的一切生物都将不复存在。
人体也是一座元素的仓库。地壳中天然存在的化学元素几乎都能在人体中找到(表 2-2)。
表 2-2 中列出的 11 种元素占了人体总质量的 99.95%,这些元素是人体必需的常量元素①,一般的食物已能满足人体对这些元素的需要。如果人体缺少这些常量元素,就会发生各种疾病,如缺钙会造成肌肉
表 2 - 2 人体中常量元素的含量
|
元素 人体中的含量(%) |
元素 |
人体中的含量(%) |
|---|---|---|
|
氧 65.00 碳 18.00 氢 10.00 氮 3.00 钙 2.00 |
磷硫钾钠氯 镁 |
1.00 0.25 0.35 0.15 0.15 0.05 |
痉挛、佝偻病、骨质疏松、发白等疾病。组成人体的还有 20 多种微量元素。例如铁、锌、铜、锰、碘等,它们占人体质量的 0.05%以下。不少微量元素也是维持人体正常生理机能必不可少的物质。例如缺铁会发生贫血,缺碘会使甲状腺肿大(粗脖子病),这些几乎是众所周知的常识。现代医学已知, 缺锌会导致儿童发育停滞,智力低下,食欲不振、味觉减退等症状;缺锰会使骨和软骨异常,先天性畸形,头发脱色等。有些元素如铅、镉、汞等,当它们在人体中的含量超过允许量时,会使人中毒。例如铅会引起贫血,损伤胃肠道、大脑,还能损害孕妇和胎儿的健康。所以这些元素叫做有毒元素。
① 常量元素是指占人体总质量 0.01%以上的元素。微量元素是指占人体总质量 0.01%以下的元素。

有毒元素常常通过呼吸道、消化道和皮肤接触等途径进入人体(图 2- 3)。例如含铅汽油燃烧产生的废气,含铅的油漆和用铅油封接的水管等,常能使人在接触过程中摄入铅。为此,我们要控制污染,保护环境,减少与有毒元素的接触,防止有毒元素进入人体。
元素符号与分子式 在历史上,化学家曾经用不同的符号来表示已知的各种元素,但表示的方法各不相同。为了便于交流,需要用一种共同的符号来表示同一种元素,于是便产生了国际通用的元素符号。
国际上规定,元素符号统一采用这种元素的拉丁文名称的第一个大写字母来表示。例如,
氧的拉丁文名称是 Oxygenium,元素符号规定为 O。氢的拉丁文名称是 Hydrogenium,元素符号规定为 H。碳的拉丁文名称是 Carbonium,元素符号规定为 C。硫的拉丁文名称是 Sulfur,元素符号规定为 S。
如果几种元素的拉丁文名称的第一个字母相同,则再附加一个小写字母加以区别。例如 Cu 代表铜元素。Ca 代表钙元素,等等。
表 2-3 列出了一些常见元素的名称、元素符号。
元素符号既表示某种元素,也可以表示某种元素的一个原子。我们还可以用元素符号表示一种物质的分子组成。例如氧化汞分子可以表示为 HgO, 二氧化碳分子可以表示为 CO2,等等。这种用元素符号来表示物质分子组成的式子称为分子式①。物质的分子式是通过实验方法测定的,一种物质只有一种分子式。
表 2 - 3 常见元素的符号
|
元素名称 |
氢 |
氧 |
氮 |
氯 |
碳 |
硅 |
磷 |
硫 |
|---|---|---|---|---|---|---|---|---|
|
元素符号 |
H |
O |
N |
Cl |
C |
Si |
P |
S |
|
元素名称 |
碘 |
溴 |
钾 |
钠 |
钙 |
锌 |
镁 |
铝 |
|
元素符号 |
I |
Br |
K |
Na |
Ca |
Zn |
Mg |
Al |
|
元素名称 元素符号 |
铁 Fe |
铜 Cu |
汞 Hg |
银 Ag |
金 An |
铅 Pb |
钡 Ba |
氟 F |
原子核外电子排布 在含有多个电子的原子里,有的电子在离核较近的
① 用元素符号表示物质组成的式子又叫化学式,分子式是化学式的一种。
空间内高速运动,有的电子在离核较远的空间内高速运动,常把这些电子看作在不同的电子层上运动(或叫做分层排布)。
电子在原子内部的这种分层排布,可以用原子结构示意图来表示。例如钠原子(Na)的结构示意图可以用图 2-4 的方式表示。

这个示意图表示钠原子的核内有 11 个带正电的质子,核外有 11 个电子,
离核较近的第一电子层有两个电子,第二电子层有 8 个电子,第三电子层(即
是钠原子的最外电子层)只有 1 个电子。
又如镁原子、氧原子、氯原子和氖原子的结构示意图可以表示为

在镁、氧、氯、氖、钠几种元素中,镁和钠是金属元素,氧和氯是非金属元素。可以看出金属元素的原子,最外层上的电子数一般小于 4 个。如钠原子
最外层上有 1 个电子,镁原子最外层上有两个电子。而非金属元素的原子,
最外层上的电子数一般多于 4 个。如氧原子最外层上有 6 个电子,氯原子最
外层上有 7 个电子。
金属元素的原子最外层电子比较少,在化学反应中容易失去这些电子, 使整个原子带上正电荷。非金属元素的原子则容易得到电子而使整个原子带上负电荷。我们把带电荷的原子叫做离子。带正电荷的离子叫阳离子,带负电荷的离子叫做阴离子。化学上常在元素符号的右上角标上电荷的数目来表示一种离子。例如,钠原子和镁原子在反应中容易失去最外层的 1 个和两个
电子,成为钠离子(Na+)和镁离子(Mg2+),而氯原子在反应中容易得到 1 个电子成为氯离子(Cl-)。
原子量 原子很小,但也有一定的质量。1μg(微克)金子里含有 3.1
×1015 个金原子,每个金原子的质量是 3.2×10-22g。这样小的质量根本无法称量。显然,用 kg 或 g 这样的质量单位来表示原子的质量是不合适的。
因此,在科学上一般不直接用原子的实际质量,而是用原子的相对质量
(简称原子量)来表示。国际上规定,以中子数为 6 个的碳原子质量的 1/12 为基准,把各种原子的质量跟它相比较而得到的比值,就是各种原子的原子 量。这样,碳的原子量是 12,镁的原子量是 24,氧的原子量是 16,等等。国际原子量表见书末附录,使用时只要查表就可以了。
药剂师
职业与化学
你一定非常熟悉医院药房里的药剂师吧。他们的工作主要是按照医生的处方配药和制备药物。除了在医院工作的药剂师外,还有些药剂师在药物研究所、制药厂、医疗预防机构(如防疫站等)工作。这些药剂师从事药物调剂、制备、鉴定和生产等工作。有的药剂师也在大专院校从事医药教学工作。药剂学是药剂师不可缺少的一门专业知识。药剂学所研究的对象是药物,因此他们必须知道药物的组成、结构和性质等知识。而这些恰恰也就是化学的研究内容。因此药剂学与化学的关系是非常紧
密的。要学好药剂学,做一名好的药剂师,就必须具有较好的化学基础知识。
讨论与思考
- 某药片中每克含碘 150mg、铁 12mg、镁 65mg、铜 2mg、锌 1.5mg、锰
1mg。你认为该药片中所含的各种成分是指分子、原子、还是元素?
- 古罗马人的平均寿命很短,只有廿余年。你认为这可能主要跟以下哪些因素有关?
-
古罗马上空的空气污染严重
-
古罗马人营养很差
-
古罗马城市中用铅作水管,用铅制器皿饮水
-
什么叫离子?铝的元素符号是 Al,铝原子很容易失去最外层的 3
个电子,试写出铝离子的符号。
-
什么叫原子量,它是以什么为基准的?氢的原子量是 1,铝的原子量是
27,铝原子的质量是氢原子的几倍?
-
查表确定 1 个铁原子的质量是 1 个氧原子质量的几倍。
阅读材料
生命的钥匙——微量元素
微量元素在人体中的含量虽然微不足道,但它们在生命活动中的作用却十分重要。人体中各种必需的微量元素无论缺少或过量,对人体的健康影响极大。因此科学家把微量元素称为“生命的钥匙”。例如,铁是人体必需的一种微量元素。人体中的血红蛋白、细胞色素,以及多种能促使生化反
应迅速进行的催化剂——酶中都含有铁元素。如果血液中铁的含量减少,血红蛋白就不能生成,造成缺铁性贫血,使流经肺部的血液携带氧气的量减少。人体得不到足够的氧气,轻者面色苍白,呼吸急促,重者甚至发生窒息死亡。为了补充铁质,医生常给患者服用硫酸亚铁一类的补血铁剂,还建议患者多吃一些猪肝和菠菜等含铁质较高的食物。
又如,氟也是人体必需的一种微量元素。牙齿的釉面上就有一层氟的化合物,它坚硬而致密, 是保护牙齿的天然屏障。如果人体中缺少氟,就会影响牙齿保护层的形成,引起龋齿。据文献报道, 当饮水中含氟量小于 0.5mg/L 时,龋齿的发病率高达 70%—90%。当饮水中含氟量为 1.5mg/L 时,龋齿的发病率可降到 10%以下。
但是,过量摄入微量元素,也不合适。例如,广州市从 1966 年起实行自来水氟化,10 年后发现儿童斑釉齿大大增加。后经调查证实,广州市饮水含氟量虽然低于国家标准,但市民从其他途径摄取的总氟量已超过人体的需求,饮用氟化水反而引起了氟过剩。所以从 1983 年起广州市已停止对自来水加氟。
越来越多的事实证明,微量元素对人体的生长、发育、衰老、疾病乃至死亡,都起着十分重要的作用。表 2-4 列出了一些微量元素的补充来源,食用有关食物,可以使人体获得必要的微量元素。反之,偏食对人体的健康是有害而无益的。
表 2-4 若干微量元素的补充来源
|
元素名称 |
来源 |
|---|---|
|
铁( Fe ) |
肝、肉、豆类、麦类、菠菜、西红柿、水果 |
|
铜( Cu ) |
坚果、豆类、谷类、水果、鱼、肉、蔬菜 |
|
锌( Zn ) |
谷类、豆类、麸皮、肝、胰脏、乳汁 |
|
锰( Mn ) |
萝卜缨、小麦、扁豆、大白菜、糙米、茄子 |
|
碘( I ) |
海带、海参、紫菜、发菜、蛭子、蚶、蛤、干贝、海蜇 |
|
硒( Se ) |
大白菜、小麦、玉米、小米、南瓜、红薯干 |
2·2 单质
元素的游离态 世界上有许许多多的纯净物,如果根据元素的组成来划分,可以分为两大类——单质和化合物。单质是由一种元素组成的纯净物。 像氧气、镁、铁、汞等都是单质。化合物是由两种或多种元素组成的纯净物(图 2-6)。例如,氧化镁是由氧元素和镁元素组成的;高锰酸钾是由钾、锰、氧三种元素组成的,它们都是化合物。
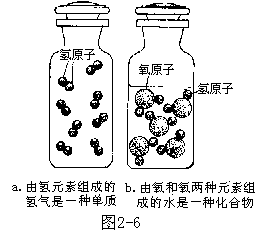
以单质存在的元素形态叫做元素的游离态。我们的祖先早就懂得“沙里淘金”,因为金在自然界里是以游离态存在的。
单质还可以按其性质分为金属、非金属和稀有气体三个大类。例如,氧气、碳都是非金属(组成非金属单质的元素叫非金属元素);铁、铝、铜都是金属(组成金属单质的元素叫金属元素)。氦气、氖气、氩气等是稀有气体。金属有金属光泽,有延展性,能导电、传热等。非金属没有金属光泽, 没有延展性,导电、传热性能差。金属和非金属之间没有绝对的界限。有的物质如硅和锗既有金属的性质,又有非金属的性质。
单质的分子式 用元素符号来表示物质分子组成的式子叫分子式。单质的分子式书写比较简单,只要在组成单质的元素符号右下角,用数字表示 1
个分子中所含的原子数目。如果原子个数是 1 时可以不写。例如,氢气、氧气、氮气、氦气、氖气的分子式分别用 H2、O2、N2、He、Ne 来表示。上式说明 1 个氢气分子中有两个氢原子,等等。
金属和固态非金属单质的结构比较复杂,习惯上用元素符号表示分子式。例如,铁、铜、硫、碳的分子式分别用 Fe、Cu、S、C 来表示。
以中子数为 6 个的碳原子质量的 1/12 为基准,以各种分子的质量跟它相比较,所得的比值就是该分子的分子量。
物质的分子量实际上就是组成该分子的各元素原子量之和。因此,根据物质的分子式,可以很方便地计算出它们的分子量。例如,氧气的分子式是O2,它的分子量就是
16×2=32
又如,白磷的分子式是 P4,它的分子量是
31×4=124
① 同素异形体 同一种元素有时可以形成几种不同的单质。例如,氧元素既可以形成分子式为 O2 的氧气,又可以形成分子式为 O3 的臭氧。氧气和臭氧是两种性质不同的单质。氧气是无嗅的气体;臭氧却具有特殊的气味。在通常情况下,氧气的密度是 1.43g/L;臭氧的密度却是 2.14g/L。

金刚石(图 2-7)和石墨是两种性质截然不同的物质。金刚石是自然界里硬度最高的矿物;石墨却是最柔软的矿物之一。金刚石晶莹透亮,熠熠闪光;石墨却呈灰黑色。纯净的金刚石不能导电;石墨是电的良导体。金刚石和石墨虽然性质不同,但它们都是碳元素的单质。
我们把像金刚石、石墨,氧气、臭氧等由同一元素形成几种不同单质的现象,称为同素异形现象。把同一元素形成的几种不同单质,互称为同素异形体。
讨论与思考
-
单质可以分成哪几类?从原子结构上分析,它们有哪些主要的区别?
-
在以下物质中,哪些是单质?哪些是化合物?为什么?
石墨(C)二氧化锰(MnO2)氯酸钾(KClO3)高锰酸钾(KMnO4)氯化钾
(KCl)硫(S8)
- 白磷和红磷都是磷元素的单质,它们互称什么?查阅化学手册,简述它们各自的物理性质。
阅读材料
同素异形现象
① 供选读。
同一种元素可以形成性质各异的两种或多种不同的单质,这种现象就称为同素异形现象,这些
不同单质称为同素异形体。如石墨、金刚石是碳的同素异形体,红磷和白磷是磷的同素异形体,氧气和臭氧(O3)是氧的同素异形体等等。同素异形体的性质有很大的差异,如氧气是无色、无味的气体,
而臭氧则是淡蓝色的气体,有鱼腥味,臭氧的氧化能力比氧气强得多。又如红磷和白磷的性质相差也很大,可以从下表看出。
金属锡有三种同素异形体,灰锡、白锡和脆锡。灰锡为粉末状,当温度低于 18℃时,白锡就会慢慢变成灰锡,温度降到-48℃时,这种转变会加速进行,以致使白锡变成一堆灰色的
粉末,这一现象称为“锡疫”。法兰西第三帝国皇帝拿破仑曾统率大军远征俄罗斯,士兵们在冰天雪地中受冻挨饿,艰难跋涉。由于气温低,军服上锡制的钮扣均患上了锡疫而脱落,加重了士兵们的冻伤。这成为拿破仑战败的原因之一。
人们早就发现,石墨和金刚石是碳的两种同素异形体,90 年代初,科学家发现了碳元素的另一种单质——巴基球,它是由 60 个碳原子以立体结构排列而成的一种笼形碳分子,如 C60 就是一种像足
球形状的碳分子。巴基球在现代高科技上有着重要的应用,对它正在深入研究中。
2·3 氧气
氧气是一种重要的非金属单质。在地球形成初期,空气的主要成分是水气、一氧化碳、甲烷和氨气,那时还没有氧气。氧气是海洋中简单植物光合作用的产物。后来,随着植物的增多,光合作用的增强,大气中氧的含量才逐渐提高,最终形成了现今的以氧气和氮气为主要成分的空气。植物在光合作用下所放出的氧气,比它在呼吸时消耗的氧气约多 20 倍,因此它弥补了自然界里氧气的消耗,使空气中氧气的含量几乎保持恒定。
氧气的制法 在工业上,氧气主要是用分离液态空气的方法来制得,也可以用电解水的方法来制取,但这种方法耗电多,成本高。在实验室里,常用加热氯酸钾或高锰酸钾的方法来制取少量氧气。
【实验 2-1】(1)把少量氯酸钾放在一支试管里加热,当氯酸钾熔化并有气泡产生时,用带火星的木条插入试管口,观察有什么现象发生(图 2-8)。
-
把少量二氧化锰放在另一支试管里加热,也用带火星的木条插入试管口,观察有什么不同的现象。
-
把少量氯酸钾放在试管里加热片刻,不等熔化,用带火星的木条插入试管口,木条没有点燃。然后迅速往试管里撒入少量二氧化锰,再用带火星的木条试验,观察发生什么现象。
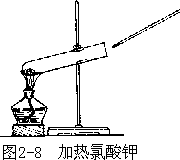
上述实验说明,把氯酸钾加热到熔化才会放出氧气;单独加热二氧化锰, 一般不放出氧气;当氯酸钾中混有少量二氧化锰时,不需要加热到熔化,就能迅速地放出氧气。可见,二氧化锰在这里起了加速氯酸钾分解的作用。在化学反应中,这种能改变其他物质的反应速度,而本身的质量和化学性质在反应前后都保持不变的物质,叫做催化剂(或触媒)。在化学工业上, 常选用适当的催化剂来增大化学反应速度,以提高生产效率。
实验室里制取氧气的化学反应可以表示如下:

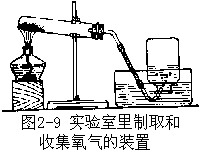
氧气是一种密度比空气大,不容易溶于水的气体,所以实验室里制取氧气可以用向上排空气法(容器口向上)或排水法来收集(图 2-9)。
氧气的氧化作用 我们说没有空气就没有生命,这是因为人是靠吸入空气中的氧气跟体内的营养物质反应所产生的能量来维持生命的。所以没有空气就会危及人的生命。医院里常用输氧抢救休克和心脏停搏的重危病人。
在空气稀薄的高山地区,氧气的含量相对较低,长期生活在平原地区的居民一下子到了高山地区常会感到气喘、胸闷而不能适应。
那么,人能不能长期呼吸纯氧气呢?物质在空气或纯氧气中反应有什么差别呢?下面我们通过实验(实验 2-2)来研究这个问题。
【实验 2-2】点燃两支短小的蜡烛,插在两根弯成钩状的铁丝上,然后分别伸进装满氧气和空气的两只集气瓶里(图 2-10),观察燃烧的现象。
① 式中 KClO3、KCl、O2 分别是氯酸钾、氯化钾和氧气的分子式。
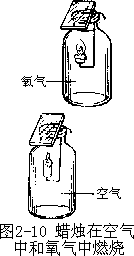
实验表明,蜡烛在氧气里燃烧比在空气里燃烧剧烈。
 【实验
2-3】把小块木炭放在燃烧匙里加热到发红,然后伸进盛有氧气的集气瓶里(图
2-11),
比较木炭在空气中和氧气中的燃烧现象。待燃烧停止后,立即向瓶内倒进一些澄清的石灰水,振荡,
观察现象。
【实验
2-3】把小块木炭放在燃烧匙里加热到发红,然后伸进盛有氧气的集气瓶里(图
2-11),
比较木炭在空气中和氧气中的燃烧现象。待燃烧停止后,立即向瓶内倒进一些澄清的石灰水,振荡,
观察现象。
实验表明,木炭(主要成分是碳)在氧气中燃烧比在空气中燃烧得更旺, 并发出更明亮的光。燃烧后生成的气体能使澄清的石灰水变浑浊,证明产生的是二氧化碳气体。
碳跟氧气的反应可以表示如下:
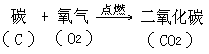
 【实验
2-4】把光亮的细铁丝做成螺旋状,一端系在一根粗铁丝上,另一端系一根火柴,将火柴点燃后,把它连细铁丝一起伸进盛有氧气的集气瓶里(瓶底铺一层细砂),见图
2-12,观察发生的现象。
【实验
2-4】把光亮的细铁丝做成螺旋状,一端系在一根粗铁丝上,另一端系一根火柴,将火柴点燃后,把它连细铁丝一起伸进盛有氧气的集气瓶里(瓶底铺一层细砂),见图
2-12,观察发生的现象。
实验 2-4 表明,细铁丝能在氧气里剧烈燃烧,火星四射,生成了叫做四氧化三铁的黑色固体。由于燃烧时放出大量的热,使生成的四氧化三铁熔化并溅落在瓶底。这个反应可以表示如下:
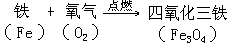
以上实验都表明,物质在纯氧里的反应比在空气里反应更激烈。人如果长期呼吸纯氧气是不能适应的。
由于物质在纯氧中反应更激烈,所以工业上常使一些反应在纯氧中进行,以提高反应效率。例如,工业上利用电石气在氧气中燃烧产生氧炔焰, 氧炔焰的温度高达 3000℃,可以用它来切割和焊接金属。炼钢时用氧气增加空气中氧的浓度以提高炉温,增大冶炼速度,从而提高钢的产量和质量。液氧是目前中远程导弹和宇航火箭推进剂的主要成分之一。液氧炸药被广泛用于开矿、挖渠、构筑隧道等。
物质在空气里燃烧或在氧气里燃烧都是物质跟氧气的反应,物质跟氧气反应时一般都有热量放出。我们把物质跟氧发生的化学反应叫做氧化反应。氧气是一种比较活泼的气体,容易跟其他物质发生反应,所以物质在空
气中发生氧化作用的现象是非常普遍的。如钢铁生锈,食物酸败,都是空气中的氧气跟这些物质发生氧化作用的结果。为了防止物质在空气中氧化变质,就要设法降低与该物质直接接触的空气中氧气的含量,或使它与空气隔绝。例如,包装食品时常用抽去空气或填充氮气的办法以防止食品变质。
讨论与思考
-
在二氧化锰、空气及液态氧气中,哪些是纯净物、哪些是混合物?为什么?
-
举例说明在生活中哪些情况下需要减小氧气的含量?哪些情况下需要增加氧气的含量?
-
实验室里用氯酸钾制取氧气的反应中,残余的固体是纯净物还是混合物?
-
铁丝在氧气中燃烧后溅落在瓶底的黑色固体物质是纯净物还是混合物?
阅读材料
拉瓦锡研究空气成分的著名实验
拉瓦锡把少量水银放在密闭的曲颈甑里,连续加热 12 天,结果发现水银沸腾以后有一部分变成红色鳞状的物质(氧化汞),而玻璃罩里空气的体积差不多减少了 1/5。拉瓦锡把点燃的蜡烛放入玻璃罩,烛火立即熄灭。放进小鼠,小鼠也窒息而死。这说明玻璃罩内的剩余气体不支持燃烧,也不能供给呼吸,这剩余的气体主要是现在所说的氮气。拉瓦锡再把水银所生成的红色氧化汞收集起来,对它加强热,又得到了水银和一种气体,而这种气体的体积正好等于空气先前减少的体积。他把这些气体重新加到原先的玻璃罩里,跟剩余的气体混合,结果得到的气体性质和空气的性质一样。拉瓦锡把这部分气体命名为氧。
3 化合物
通过本章的学习,你将能够
-
知道什么叫化合物。理解化合物的概念。
-
根据元素的化合价,正确地写出化合物的分子式。
-
根据某些物质的分子式,读出它的名称。
-
根据物质的分子式计算它的分子量。
-
根据化合物的分子式计算各元素的百分含量。
3·1 化合物
元素的化合态 化合物是由两种或两种以上元素组成的纯净物。在化合物中,元素以化合态的形式存在。在自然界里,我们可以找到单质的碳——金刚石、石墨等,却很难找到游离态的铁等。因为铁元素总是以化合态存在于化合物中。例如,赤铁矿的主要成分是氧化铁,它的分子式是 Fe2O3,要从氧化铁中得到游离态的铁元素,即要得到单质铁,必须对它进行冶炼加工。 在化合物中,有些是由两种元素组成的。如果这类化合物中,有一种元素是氧元素,这种化合物就叫做氧化物。氧化镁(MgO)、二氧化碳(CO2)、氧化汞(HgO)、氧化铁(Fe2O3)都是氧化物。
化合物有固定的组成 碳在空气中燃烧,可以产生二氧化碳。这个反应可以用下面的式子①来表示
C+O2=CO2
天然气的主要成分是甲烷(CH4),燃烧天然气也可以产生二氧化碳。这个反应可以用下式表示
CH4+2O2=CO2+2H2O
从以上两个反应中可以看出,无论是燃烧碳还是燃烧天然气,都可以产生二氧化碳。人在呼吸过程中,同样可以产生二氧化碳。这些从不同反应中产生的二氧化碳,都具有相同的组成。这个事实告诉我们,元素和元素化合时,它们的原子个数都有确定的比值。这是元素的一种重要性质。化学上把元素一定数目的原子跟其他元素一定数目的原子化合的性质叫做元素的 化合价。
化合价有正价和负价之分。通常,氢和金属元素在跟非金属元素化合时, 氢和金属元素显正价,非金属元素显负价。例如,在水(H2O)中氢显正价, 氧显负价。氧元素在跟金属元素或非金属元素化合时,氧元素显负价,金属元素或非金属元素显正价。例如,在氧化钙(CaO)中,钙显正价,氧显负价。许多元素还因形成化合物时的条件变化而显示出不同的化合价。例如,铁跟氧化合时铁显+2 价(FeO)或+3 价(Fe2O3),硫跟氧化合时硫显+4 价(SO2) 或+6 价(SO3)。
各种元素在化合物中正价和负价的代数和等于零。
由于元素彼此化合时它们的原子个数都有确定的比值,所以形成的化合物都有固定的组成。
① 用元素符号和化学式表示化学反应的式子叫做化学方程式。
元素化合价是元素在跟其他元素形成化合物时表现出来的性质,因此, 在单质分子里元素的化合价为零。
常见元素化合价如表 3-1 所示。
表 3 - 1 常见元素的化合价
|
元素 名称 |
元素 符号 |
常见的 化合价 |
元素 名称 |
元素 符号 |
常见的 化合价 |
|---|---|---|---|---|---|
|
钠 |
Na |
+1 |
氢 |
H |
+1 |
|
镁 |
Mg |
+2 |
氧 |
O |
-2 |
|
锌 |
Zn |
+2 |
氯 |
Cl |
-1 、+1 、 +5 、+7 |
|
铝 |
Al |
+3 |
硫 |
S |
-2 、+4 |
|
+6 |
|||||
|
铜 |
Cu |
+1 、+2 |
碳 |
C |
-4 、+2 |
|
铁 |
Fe |
+2 、+3 |
氮 |
N |
+4 -3 、+2 |
|
+4 、+5 |
在化学反应中,某些元素原子集合在一起作为一个整体而参加反应,就像一个原子一样,这种原子的集合体叫做原子团。氢氧根(OH)、硫酸根(SO4)、碳酸根(CO3)等是常见的几种原子团。根也有化合价。例如,氢氧根是-1 价,硫酸根是-2 价,碳酸根是-2 价。
在化合物中各元素的化合价,可以在分子式中各元素符号的正上方用数字加“+”、“-”号表示出来,“+”表示正价,“-”表示负价。例如,

同样,根的化合价也可以表示如下:
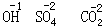
化合价与原子结构的关系 元素组成化合物时,元素的化合价与原子最外层电子的数目有密切关系。表 3-2 列出一些元素的原子最外层电子数和化合价。
从表中可以看出,氢或金属元素的化合价数一般等于它原子的最外层电子数。例如,镁原子最外层电子数是 2 个,它的化合价是+2。而非金属元素
的化合价一般等于 8 减去它们原子的最外层电子数。
表 3 - 2 原子最外层电子数和元素的化合价
| 原子 |
最外层 电子数 |
元素 化合价 |
原子 |
最外层 电子数 |
元素负 化合价 |
|---|---|---|---|---|---|
| 氢 |
1 |
+ 1 |
氯 |
7 |
-1 |
| 钠 |
1 |
+ 1 |
氧 |
6 |
-2 |
| 镁 |
2 |
+ 2 |
硫 |
6 |
-2 |
| 铝 |
3 |
+ 3 |
氮 |
5 |
-3 |
具有可变化合价的元素,情况比较复杂,不能单纯地根据原子的最外层电子数决定元素在化合物中的正、负化合价。
化合价和分子式 根据化合物中各元素正、负化合价代数和为零的原则,我们可以应用化合价写出化合物的分子式,也可以从分子式计算元素的化合价。
【例题 1】 已知铝的化合价是+3,氧的化合价是-2,写出铝的氧化物分子式。
【解】 先写出组成化合物的元素符号,正价的元素写在左面,负价的元素写在右面。
AlO
求出两元素的正、负化合价绝对值的最小公倍数。
3×2=6
求出各元素的原子数。
原子数 = 最小公倍数
正价数(或负价数)
Al: 6 = 2
3
O: 6 = 3
2
然后把原子数写在各元素符号右下方,即得分子式 Al2O3。答:铝的氧化物分子式是 Al2O3。
【例题 2】 已知氧的化合价为-2 价,钾的化合价为+1 价,试计算出高锰酸钾(KMnO4)中锰元素的化合价。
【解】 根据化合物中各元素正、负化合价代数和为零的原则,即钾的化合价×钾的原子数+锰的化合价×锰的原子数+氧的化合价×氧的原子数=0。
设 KMnO4 中锰的化合价为 x,
则 (+1) ×1+ x × 1+ (−2) × 4 = 0
(+1) ×1 + (−2) × 4
x = 1
= +7
答:在 KMnO4 中锰元素的化合价是+7 价。
分子式只能用于表示客观存在的物质的组成。所以,只有确实存在的化合物,才能根据元素的化合价写出它的分子式,而不能利用化合价任意写出实际上不存在的物质的分子式。
分子式的读法 化合物分子式的读法一般是有规律的。由两种元素组成的化合物名称,一般从分子式右边的元素名称向左读,读作“某化某”。
例如,NaCl 读作“氯化钠”。
有时还要读出化合物里每一个分子中元素的原子个数。例如,CO2 读作二氧化碳,P2O5 读作五氧化二磷。
如果是由原子团组成的复杂化合物,其中原子团一般只读它的名称。例如,Na2CO3 读作碳酸钠,Na2SO4 读作硫酸钠。
分子式是用来表示某种物质的 1 个分子。如果要表示几个分子,可以在分子式的前面加上系数。例如,2CO2 表示两个二氧化碳分子;5HCl 表示 5 个氯化氢分子。书写分子式时,应注意元素符号右下角的数字和元素符号前面数字的意义是完全不同的。例如,2CO2 中系数 2 表示二氧化碳分子的个数,
分子式中的 2,则表示 1 个二氧化碳分子中有两个氧原子。
讨论与思考
- 根据常见元素的化合价判断以下分子式是否正确。
(1) NaCl2(2)FeCl3(3)FeCl2(4)Na2O(5)Al2O
(6)AlCl3(7)ZnO2(8)ZnCl(9)NO2(10)SO3
-
钙原子最外层有两个电子,它在化合物中显几价?写出氯化钙的分子式。
-
钾原子最外电子层有 1 个电子,溴原子最外电子层有 7
个电子。试判断钾和溴的主要化合价分别是多少?写出钾跟溴形成化合物的分子式。
-
根据氢原子和氮原子最外层电子的数目,分析一下为什么氢和氮形成化合物氨(NH3)时,氨分子中氢原子和氮原子的个数比是
3∶1。
-
在磷酸根(PO4)中,磷的化合价是+5,则磷酸根的化合价是多少?
-
铵根(NH4)在化合物中显+1 价,则 NH4 和 Cl
形成化合物的分子式是怎样的?为什么?
-
在硫酸根(SO4)中,硫的化合价是+6,则硫酸根的化合价是多少?分
子式 NaSO4 是否正确?
- 硝酸根(NO3)的化合价是-1,则其中氮元素的化合价是多少
9.读出以下物质的名称。
(1)NaOH(2)Na2SO4(3)K2CO3(4)ZnSO4
阅读材料
原子学说和定组成定律
任何化合物,不论它的来源如何,也不管它是用什么方法制得的,只要是纯净的,都有固定不变的组成。这就是定组成定律。它是化学的基本定律之一。
- 世纪后,工业革命席卷欧洲,工业的迅猛发展推动了化学科学的发展。化学家们开始探索化合物的组成及其形成过程中各物质之间量的关系。化学家卡文迪许测定了水的组成,发现氢气和氧气是以一定的体积比结合成水的。化学家拉瓦锡也发表了对氧化汞组成的测定结果。1799 年,法国人普罗斯特根据他的实验结果明确指出:“两种或两种以上的元素相互化合成某一化合物时,不同元素间其重量的比例是天然一定的,人力不能增减。”这就是定组成定律的最早叙述。
普罗斯特一提出定组成定律,立刻遭到当时的化学权威贝塞莱的激烈反对,并由此爆发了一场长达 8 年之久的论战。但后来的种种实验事实表明,普罗斯特是正确的。
为什么纯净的化合物都有固定的组成呢?自从道尔顿提出原子学说以后,这个定律就成了原子学说的自然推论,它的正确性也就不言而喻了。
道尔顿的原子学说认为,原子是元素的最小微粒,它在化学反应中不能再分。同种元素的原子不仅形状大小相同,而且质量也相同。当元素相互化合形成化合物时,也就是元素的原子相互结合成化合物时,原子的个数和质量都有一定的比例,所以纯净的化合物都有固定不变的组成。
3·2 根据分子式进行的计算
计算物质的分子量 1 个分子中各原子的原子量总和就是该物质的分子量,因此根据分子式可以计算出各种物质的分子量。
[例题 1]计算三氧化硫的分子量。[解]三氧化硫的分子式是 SO3。SO3 的分子量=32×1+16×3=80 [例题 2]计算氧化铁的分子量。
[解]氧化铁的分子式是 Fe2O3。
Fe2O3 的分子量=56×2+16×3=160
计算化合物中各元素的质量比 根据分子式可以计算出组成化合物的各元素的质量比。
[例题 3]计算水中氢、氧两种元素的质量比。[解]水的分子式是 H2O。
氢元素质量:氧元素质量=1×2∶16=1∶8 [例题 4]水电解的产物是氢气和氧气。
如果在阴极得到 10g 氢气,试计算在阳极上可以得到多少克氧气? [解]水中氢元素质量:氧元素质量=1∶8
设可以得到氧气 xg。则 1∶8=10∶x
x = 8 × 10 = 80(g)
1
答:可以在阳极上得到 80g 氧气。
计算化合物中各元素的百分含量 农业上要选用某种氮肥,就要知道这种氮肥的含氮量,根据氮肥的含氮量及土壤中应施入氮素的量来确定应施加氮肥的质量。勘探队员要确定某种铁矿石有没有开采的价值,也要知道这种矿石中铁元素的百分含量。根据化合物的分子式就可以计算出其中某一元素的百分含量,并根据元素的百分含量进一步计算出一定量该化合物中各元素的质量。
[例题 5]计算化肥硝酸铵(NH4NO3)中氮元素的百分含量。[解] NH4NO3 的分子量=14×2+1×4+16×3=80。
职业与化学
营养学家
人体活动需要能量,这种能量来自于某一种“燃料”。食物就是这种“燃料”。食物在人体内进行着许许多多的化学反应,产生许多能量供人体活动所需。营养学家的工作之一就是合理调整这种“燃料”的摄入,以及“燃料”的质量,因此他必须具有一定的化学知识。特别是有机化学知识和生物化学知识。你如果立志要成为一名营养学家,眼下就必须好好学习化学。
有许多营养学家受聘于医院。他们的工作是根据病人的病情和需要,通过膳食增加营养和配合药物治疗,以增强体力,使患者能早日恢复健康。例如根据不同病人的病情,分别给以流质、半流质、软食、高蛋白质饮食、无盐或少盐饮食等。这种治疗称为饮食治疗,它对各种营养缺乏病、代谢病、消化性溃疡、心血管病都能起到一定的积极治疗作用。
2N
氮元素的百分含量 = NH NO
×100%
= 14 × 2 ×100% = 35%
80
答:硝酸铵中含氮元素 35%。
[例题 6]有一种铁矿石的主要成分是 Fe2O3。试计算含 Fe2O3500t 的铁矿石中有多少吨铁? [解]Fe2O3 中铁元素的百分含量
2Fe
